Zinn(II)-iodid
| Kristallstruktur | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| _ Sn2+ _ I− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Zinn(II)-iodid | ||||||||||||||||||
| Andere Namen | Zinndiiodid | ||||||||||||||||||
| Verhältnisformel | SnI2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 372,52 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[2] | ||||||||||||||||||
| Dichte | 5,28 g·cm−3 (25 °C)[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 714 °C[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Zinn(II)-iodid ist eine anorganische chemische Verbindung des Zinns aus der Gruppe der Iodide.
Gewinnung und Darstellung
Zinn(II)-iodid kann durch Reaktion von Zinn mit Iod bei mehr als 600 °C gewonnen werden, wobei sich erst Zinn(IV)-iodid bildet, das mit überschüssigem Zinn zu Zinn(II)-iodid reagiert.[4]
Es kann auch durch Reaktion einer Zinn(II)-chloridlösung mit Kaliumiodid dargestellt werden[5]:
Eigenschaften
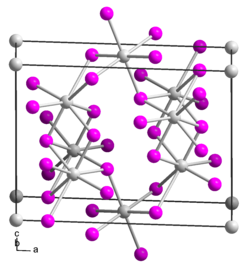
Zinn(II)-iodid ist ein gelber bis roter Feststoff,[2] der wenig löslich in Wasser ist. Er besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12), den Gitterparametern a = 1417 pm, b = 453,5 pm, c = 1087 pm, 92° und sechs Formeleinheiten pro Elementarzelle.[3] Mit Halogeniden bildet es Halogenkomplexe.[6]
Einzelnachweise
- ↑ Datenblatt Tin(II) iodide, ultra dry, 99.999% (metals basis) bei Alfa Aesar, abgerufen am 23. Juli 2013 (Seite nicht mehr abrufbar).
- ↑ a b c d e f g h i Datenblatt Zinn(II)-iodid, 99.999% trace metals basis bei Sigma-Aldrich, abgerufen am 24. April 2024 (PDF).
- ↑ a b c Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. Springer DE, 1997, ISBN 3-540-60035-3, S. 740 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Andrea Krüger: Strukturchemische Untersuchungen von neuen binären und ternären ... Herbert Utz Verlag, 1999, ISBN 3-89675-472-6, S. 25 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Anil Kumar De: A Text Book of Inorganic Chemistry. New Age International, 2007, ISBN 81-224-1384-6, S. 377 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 965.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Autor/Urheber: Andif1, Lizenz: CC BY-SA 4.0
Crystal structure of tin(II) iodide. Created using Diamond 4. Data from R. A. HOWIE, W. MOSER* AND I. C. TREVENA The Crystal Structure of Tin(II) Iodide Acta Cryst. (1972). B28, 2965





