Zervikale intraepitheliale Neoplasie
Die Zervikale Intraepitheliale Neoplasie (CIN), auch Squamöse Intraepitheliale Läsion (SIL) genannt, stellt eine Dysplasie des Epithels des Gebärmutterhalses dar, deren schwerste Form (CIN III) als Präkanzerose gilt. Ursacher ist eine Infektion mit bestimmten, sogenannten Hochrisiko-Typen des Humanen Papillom-Viruses.
Krankheitsbild
Die CIN wird in drei Schweregrade eingeteilt:
- CIN I: (leichte Dysplasie) geht von basal aus bis höchstens einem Drittel der Höhe des Epithels;
- CIN II: (mittelgradige Dysplasie) bis zu zwei Drittel des Epithels;
- CIN III: (hochgradige Dysplasie) durchzieht fast das gesamte Epithel (Carcinoma in situ).
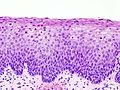
Normales zervikales Epithel.
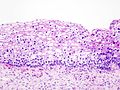
Grad I CIN.
Grad II CIN.
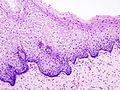
Grad III CIN.
Die CIN III gilt als sogenannte obligate Präkanzerose, das heißt, dass ein Übergang zum Zervixkarzinom sehr wahrscheinlich ist.
Das Durchschnittsalter der Patientinnen beim Auftreten einer für CIN I und CIN II beträgt 24–27 Jahre. Etwa die Hälfte der CIN-1-Läsionen bilden sich zurück. Rund 10 % schreiten bis zum CIN III voran und 2 % werden zu einem invasiven Cervixkarzinom. Die Prognose ist in einem hohen Maß abhängig vom Virustyp. Während Dysplasien durch Infektionen mit sogenannten low-risk Papillom-Viren sich meist spontan zurückbilden, führen sogenannte high-risk Papillom-Viren häufig zu einer CIN III und, wenn sie nicht behandelt werden, zu einem Zervixkarzinom. Das Durchschnittsalter der Patientinnen bei der Entdeckung einer Läsion der Stufe CIN III rangiert zwischen 35 und 40 Jahren.[1]
Die Begriffe CIN und Dysplasie wurden in den vergangenen Jahren vor allem im angloamerikanischen Raum immer mehr zugunsten der Bezeichnung low-grade und high-grade squamous intraepithelial lesion (LSIL und HSIL) aufgegeben. Dabei entspricht die CIN I der LSIL, CIN II und CIN III der HSIL. In der 2017 novellierten Fassung der WHO-Klassifikation von Tumoren wurde die Einteilung in LSIL und HSIL zum Standard erklärt, eine Unterteilung in CIN II und CIN III ist aber weiterhin möglich.[2]
Geschichte
1908 beschrieb Walther Schauenstein eine Epithelveränderung am Gebärmutterhals, die alle Anzeichen einer zellulären Entartung zeigte, ohne allerdings in das Bindegewebe einzudringen, und vermutete, dass es sich dabei um die Frühform eines Zervixkarzinoms handelt.[3] Eine Einteilung nach dem Befall der Epithelschichten wurde erstmals von Schottländer und Kermauner 1912 vorgenommen.[4] Sie werteten die CIN III als vollwertiges Karzinom, weshalb diese Veränderung in den folgenden Jahrzehnten mit radikalen operativen Eingriffen (Wertheim-Meigs-Operation) behandelt wurde. Erst in den 1950er Jahren setzte sich die Konisation als weniger aggressives Therapieverfahren durch.
Verlaufsstudien in den 1960er Jahren sprachen dafür, dass die CIN I ein extrem hohes Risiko des Übergangs in eine CIN III und letztlich ein Zervixkarzinom habe. Obwohl die Studien schwere methodische Mängel aufwiesen, wurden CIN I-Erkrankungen daraufhin zum Teil bis in die 1990er Jahre hinein mit einer Konisation behandelt.
Eine infektiöse Ätiologie der Erkrankung wurde schon früh angenommen. Hinweise auf eine Infektion als Ursache des Zervixkarzinoms bestanden schon seit dem 19. Jahrhundert. Der italienische Arzt D. Rigoni-Stern beobachtete bereits 1842, dass das Zervixkarzinom fast nur bei Frauen auftrat, die Geschlechtsverkehr hatten.[5] Im frühen 20. Jahrhundert wurde ein Zusammenhang mit Syphilis und Gonorrhoe vermutet[4], später mit Infektionen mit Herpes genitalis[6]. 1976 stellte Harald zur Hausen die These auf, dass das HPV-Virus eine maßgebliche Rolle bei der Entstehung des Zervixkarzinoms spielt.[7] 1983 gelang seiner Arbeitsgruppe der Nachweis von HPV 16-DNA in nahezu der Hälfte der analysierten Zervixkarzinome.[8] In den folgenden Jahren konnte auch die Assoziation von Hochrisiko-HPV-Typen mit der Entstehung der CIN III nachgewiesen werden.[9]
Therapie
Die Behandlung der CIN hängt vom Schweregrad der Veränderung ab. Bei einer leichten Dysplasie (CIN I) geht man von einer Spontanrückbildungsrate von 50 bis 70 Prozent aus, daher wird hauptsächlich zuwartend vorgegangen und in regelmäßigen Abständen untersucht, ob und wie sich die Dysplasie weiterentwickelt. Bei mittelgradigen Dysplasien (CIN II) liegt die Rückbildungsrate bei etwa 30–50 Prozent. In diesem Fall entscheidet man zwischen einem zuwartenden Vorgehen mit regelmäßigen Kontrollen oder einer Entfernung des betroffenen Areals am Muttermund mittels Konisation oder Laser-Vaporisation. Die Entscheidung ist dabei neben Faktoren wie Dauer der Erkrankung, Ausdehnung der Veränderung und Wunsch der betroffenen Frau auch vom nachgewiesenen HPV-Typ abhängig. Bei schwergradigen Dysplasien (CIN III) liegt die Spontanregressionsrate nur noch bei 10 Prozent. Da die CIN III unbehandelt mit hoher Wahrscheinlichkeit in ein invasives Zervixkarzinom übergeht, wird sie üblicherweise operativ mittels Konisation behandelt.
Einzelnachweise
- ↑ Stanley Robboy, Maria Merino, George Mutter: The Female Reproductive System. In: Raphael Rubin, David Strayer et al.: Rubin's Pathology. 5. Auflage. Philadelphia 2008, S. 798.
- ↑ S3-Leitlinie Prävention des Zervixkarzinoms. Version 1.0, 2017.
- ↑ Walther Schauenstein: Histologische Untersuchungen über atypisches Plattenepithel an der Portio und an der Innenfläche der Cervix uteri. In: Archiv für Gynäkologie. Band 85, Nr. 3, 1908, S. 577–616.
- ↑ a b J. Schottländer, F. Kermauner: Zur Kenntnis des Uteruskarzinoms: Monographische Studie über Morphologie, Entwicklung, Wachstum. S. Kager, Berlin 1912.
- ↑ D. Rigoni-Stern: Fatti statistici alle mallattie cancerose che servirono di base alle poche cose dette dal dottore Rigoni-Stern il di 23 settenbre alla Sotto-sezione di chirurgia del IV Congresso degli scienzati Italiani. In: Giornale per servire ai progressi della patologia e della terapeutica. Band 2, Nr. 2, 1842, S. 499–517.
- ↑ W. E. Rawls et al.: Herpesvirus Type 2: Association with carcinoma of the cervix. In: Science. Nr. 161, 1968, S. 1255–1256.
- ↑ Harald zur Hausen: Condylomata acuminata and human genital cancer. In: Cancer research. Nr. 36, 1976, S. 794.
- ↑ M. Dürst, L. Gissmann, H. Ikenberg, H. zur Hausen: A papillomavirus DNA from a cervical carcinoma and its prevalence in cancer biopsy samples from different geographic regions. In: Proceedings. National Academy of Sciences (USA). Band 80, 1983, S. 3812–3815.
- ↑ R. M. Richart: Causes and management of cervical intraepithelial neoplasia. In: Cancer. Band 60, 1987, S. 1951–1959.
Auf dieser Seite verwendete Medien
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird KGH als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Histopathologic image of cervical intraepithelial neoplasia (CIN3). H & E stain.
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird KGH als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Histopathologic image of cervical intraepithelial neoplasia with koilocytosis. H & E stain.
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird KGH als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Histopathologic image of normal nonkeratinizing cervical epithelium. H & E stain.
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird KGH als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Histopathologic image of cervical intraepithelial neoplasia (CIN2). H & E stain.