Würfelquallen
| Würfelquallen | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Carybdea marsupialis („Mittelmeer-Seewespe“) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Cubozoa | ||||||||||||
| Werner, 1975 |
Die Würfelquallen (Cubozoa) bilden eine kleine, fast ausschließlich marin vorkommende Klasse der Nesseltiere (Cnidaria) mit derzeit etwa 50 beschriebenen Arten. Der Name rührt vom würfel- (bis quader-)förmigen Schirm der Meduse her. Es handelt sich um einzeln lebende Nesseltiere mit festsitzendem Polypenstadium und freilebendem Medusenstadium. Die Medusenbildung erfolgt meist durch vollständige Metamorphose des Polypen, seltener durch eine besondere Form der Strobilation[1] (Abschnürung). Sie kommen weltweit meist in tropischen und subtropischen Meeren vor; die Polypenentwicklung findet bei einigen Arten auch in ästuarinen Bereichen mit wechselnden Salzgehalten statt. Selten dringen einzelne Arten auch in gemäßigte Breiten vor. Würfelquallen sind aktive, räuberisch lebende Tiere, die in ihrem Bewegungs- und Wanderungsverhalten eher mit Fischen zu vergleichen sind. Sie gehören damit zum Nekton der Meere.
Zu den Würfelquallen gehören die wohl am meisten gefürchteten Quallenarten, darunter die Carukia barnesi, eine Art aus der „Irukandji“-Gruppe, die neben anderen Arten das Irukandji-Syndrom auslösen kann, und Chironex fleckeri aus der Gruppe der „Seewespen“, deren Gift einen Menschen unter Umständen innerhalb von wenigen Minuten töten kann.
Die älteste fossile Würfelqualle stammt aus dem Pennsylvanium (Karbon). Stammesgeschichtlich sind ihre engsten Verwandten vermutlich die Stielquallen (Staurozoa).
Merkmale

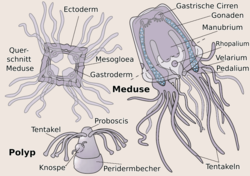
Würfelquallen sind metagenetische solitäre Nesseltiere mit einem vergleichsweise kleinen sessilen Polypen und einer im Adultstadium deutlich größeren freilebenden Meduse. Bei den meisten Arten erfolgt die Medusenbildung durch eine vollständige Metamorphose des Polypen, der Polyp bildet sich also vollständig in eine einzige Meduse um. Neuerdings wurde jedoch bei der Art Carybdea marsupialis[2] ein zweiter Typ der Medusenbildung beobachtet, eine modifizierte Strobilation, bei der ein regenerativer Rest des Polypen übrig bleibt, der wieder zum Polypen auswachsen kann.[1] Die Polypen sind recht klein und messen nur wenige Millimeter. Die Medusengröße im Erwachsenenstadium reicht von etwa 1 Zentimeter bis etwa 30 Zentimeter Schirmhöhe oder Schirmdurchmesser. Meist ist die Höhe deutlich größer als der Durchmesser. Einige Arten können bis zu drei Meter lange Tentakel ausbilden,[3] die Schirmgröße besagt also nicht viel über die Gesamtgröße. Schirmgallerte und alle Organe der Meduse sind durchsichtig. Bei den meisten Arten ist der Lebenszyklus bisher noch unbekannt. Gut untersucht sind nur Carybdea marsupialis[2] und Tripedalia cystophora, so dass sich die meisten Beobachtungen am Polypen auf diese beiden Arten beschränken.
Polyp
Der Polyp ist radialsymmetrisch ohne festes Skelett und gewöhnlich mit einer Basalscheibe am Untergrund festgewachsen. Bei Carybdea marsupialis ist er meist nackt, nur bei Tripedalia cystophora wurde bisher eine Peridermhülle im unteren Teil des Polypen nachgewiesen. Die Oberfläche ist bei Carybdea marsupialis mit Geißeln besetzt, bei Tripedalia cystophora sind diese steif und fungieren als Sinneshaare. Die Körperwand besteht aus Epidermis und Gastrodermis mit der dazwischen liegenden, primär zellfreien Mesogloea, die als Stützlamelle fungiert. Er besitzt einen einheitlichen sackförmigen Gastralraum mit einem Nervenring. Im Ruhezustand kann die Gastrodermis längsgefaltet sein. Es handelt sich dabei aber nicht um Scheidewände (Septen), wie z. B. bei den Blumentieren (Anthozoa), denn die Einfaltungen verschwinden wieder, wenn der Gastralraum gedehnt wird. Die Tentakel sind in einem Kranz um den Mund angeordnet; der Mundkegel (Proboscis) mit dem Mund überragt den Tentakelkranz deutlich. Er ist sehr dehn- und streckbar und kann daher im gestreckten Zustand eher einem Rüssel ähneln. Der Körperbereich unter dem Tentakelkranz ist etwas erweitert und enthält den Magen. Der untere Bereich des Polypen ist wieder etwas schmaler (Stiel) und endet in einer Haftscheibe, mit der der Polyp am Substrat angeheftet ist. Die soliden Tentakel sind nur an der Basis etwas verdickt, ansonsten im ausgestreckten Zustand annähernd gleich dünn. Im kontrahierten Zustand haben sie die Form einer kugeligen Knospe, oder sie können fast vollständig in den Körper zurückgezogen sein. Bei den wenigen untersuchten Arten sitzt meist nur eine einzige Nesselzelle an der etwas verdickten Spitze eines jeden Tentakels. Verbrauchte Nesselzellen werden durch nachwandernde Nesselzellen ersetzt. Bei Tripedalia cystophora sitzen dagegen im Bereich der Tentakelspitze etwa 20 bis 40 Nesselzellen. Die Polypen weisen nur einen einzigen Typus von Nesselzellen auf, sogenannte Stenotelen. Die bisher untersuchten Arten sind durch einen relativ kleinen Polypen gekennzeichnet, der meist nur wenige Millimeter groß wird, bevor er sich metagenetisch in eine Meduse umwandelt. Auch bei Arten, deren Medusenstadium eine beträchtliche Größe (ca. 30 cm) erreichen kann, wird der Polyp nur wenige Millimeter groß. Die Polypen sind nach etwa drei Monaten erwachsen. Der Polyp von Tripedalia cystophora ist zu einer begrenzten Fortbewegung fähig. Er kann sich vom Untergrund ablösen und kriechend einen neuen Lebensraum bzw. Substrat suchen. Im Kriechstadium ähnelt er einem Sekundärpolypen, der sich durch Knospung an einem adulten Polypen gebildet hat. Bei ungünstigen Lebensbedingungen kann sich der Polyp auch einkapseln (encystieren). Er zieht alle Tentakel ein, wird kugelig und umgibt sich mit einer dünnen Peridermhülle. In diesem Zustand kann er auch leicht von Strömungen verfrachtet werden. Werden die Lebensbedingungen wieder günstiger, löst er sich aus der Hülle und sucht sich kriechend einen neuen Standort, wo er sich anheftet.
Die Metamorphose beginnt durch Ausbildung von vier Längsfurchen, die die Oberseite des Polypen in vier Quadranten einteilen. Die beim Polypen in einem Kreis regellos verteilten Tentakel werden zu vier Gruppen zusammengefasst; die Tentakelbasen verschmelzen. Die Tentakel werden resorbiert und die vier verschmolzenen Tentakelbasen zu den Rhopalien umgewandelt. In den Interradien wachsen neue Tentakel. Der vorher einheitliche Gastralraum des Polypen wird in den gegliederten Gastralraum der Meduse umgewandelt. Das Manubrium und das Velarium, eine muskulöse Hautfalte, die die Schirmöffnung verengt, werden gebildet. Der Basalteil wird nun fast vollständig in den oberen Teil des Schirms der Meduse mit einbezogen. Nach Ausdifferenzierung der Muskulatur der Meduse bildet sich auch die basale Haftscheibe zurück und die Meduse schwimmt davon. In der Regel bleibt nur ein Schleimfleck oder bei Tripedalia cystophora der Peridermbecher zurück. Die Metamorphose dauert bei 25 bis 27 °C etwa fünf bis sieben Tage.
Meduse
Die Meduse ist tetraradial, d. h., sie besitzt einen in der Aufsicht annähernd quadratischen, ganzrandigen Schirm (Umbrella). Die Kanten des Schirms sind gerundet, und meist ist die Höhe deutlich größer als der Durchmesser, so dass der Schirm eher seltener würfelförmig (Name!), sondern häufiger quaderförmig ist. Bei starker Rundung der seitlichen Kanten des Quaders kann die Form auch als glockenförmig bezeichnet werden. Die vier (gerundeten) Kanten des Schirms, auch pedaliale Schultern genannt, befinden sich in den sog. Interradien, die Perradien bilden die Seiten des Würfels. Die Oberseite des Schirms ist gewölbt und wird auch als Exumbrella bezeichnet, die nach innen gebogene Unterseite wird Subumbrella genannt. Die Exumbrella ist durch acht radiale Furchen gegliedert, die jeweils vom Apex (Spitze) zu den Kanten und zu den Mitten der vier Seiten verlaufen. In den Furchen ist die Schirmgallerte etwas dünner. Die Furchen sind nicht bei allen Arten deutlich ausgebildet und können zudem mit zunehmendem Alter undeutlicher werden. Der Apex kann zusätzlich noch durch eine Ringfurche etwas hervorgehoben sein. Teile oder auch die gesamte Exumbrella können mit Warzen besetzt sein, die oft ein regelmäßiges Muster erkennen lassen. Die Warzen sind meist mit Nesselzellen besetzt. Die Exumbrella zeigt oft eine charakteristische Färbung.
Der Schirmrand ist ganzrandig, im Gegensatz zum gelappten Schirmrand bei Medusen der Scyphozoa. Die (untere) Öffnung des Schirms kann durch eine muskulöse Hautfalte verengt sein, das Velarium. Dieses ist ausschließlich aus Zellschichten der Subumbrella gebildet, also nicht direkt homolog zum Velum der Hydrozoa, das aus epidermalen Schichten von Exumbrella und Subumbrella hervorgeht. Das Velarium ist von Velarkanälen durchzogen, die mehr oder weniger stark verzweigt sind. Form und Zahl der Velarkanäle sind oft artspezifisch.
Das Innere der Meduse ("Gastrovascularsystem") enthält den Innenraum des Manubrium, den Magen, die vier Gastraltaschen und einen randlichen Ringkanal, von dem aus die Kanäle in die Pedalien bzw. Tentakel, das Velarium und in die Rhopalien abgehen. Der flache Magen liegt am oberen Ende bzw. im Apex der Subumbrella. Über den weiten Innenraum des Manubriums kann die Nahrung in den Magenraum gelangen. Von den interradialen Bereichen der Magenwand reichen büschelförmige, drüsige Gastralfilamente in den Mageninnenraum. Sie produzieren Verdauungssekrete. Vier perradiale Ostien, die durch eine Klappe verschließbar sind, verbinden den Mageninnenraum mit den flachen, den Schirmseiten innen anliegenden Gastraltaschen. Diese werden damit von gastrodermalen Zelllagen von Exumbrella und Subumbrella gebildet. Die Gastraltaschen sind durch schmale, interradiale, vertikale Leisten oder Septen voneinander getrennt. Im unteren Teil, bis etwa auf Höhe der Rhopalien teilt sich jede Gastraltasche durch Ausstülpungen der Wand in zwei schmalere, vertikale randliche Taschen. Diese acht randlichen Taschen stehen jedoch am Außenrand miteinander in Verbindung und bilden so einen Ringkanal. In den oben Gastraltaschen befinden sich die blattförmigen Gonaden (Geschlechtsdrüsen), die paarig an den vertikalen Septen ansetzen. Bei Tripedalia cystophora findet die Befruchtung der Eier in den Gastraltaschen statt und die aus den befruchteten Eiern sich entwickelnden Larven verlassen den Gastralraum erst nach einigen Tagen.
Das Nervensystem besteht aus einem subumbrellaren Nervenring, der sich in der Nähe des Schirmrandes befindet. Er verbindet die Sinnesorgane (Rhopalien) und die Tentakel. Die Subumbrella weist zudem ein diffuses Nervennetz mit zahlreichen Ganglienzellen auf.
Die Tentakel inserieren an den unteren Ecken des Würfels bzw. Quaders, also interradial. Sie setzen jedoch nicht direkt am Schirm an, sondern an zwischengeschalteten sog. Pedalien. Der Begriff wird jedoch für zwei etwas unterschiedliche Strukturen verwendet. Bei den Carybdeida handelt es sich um grob dreieckige oder ruderähnliche Strukturen, wobei die Ruder(blätter) senkrecht zur Körperoberfläche angeordnet sind. Sie sind muskulös, aber nicht kontraktil. Sie können jedoch nach außen und innen gebogen werden und unterstützen das gerichtete Schwimmen sowie den Transport von Nahrung zum Mund. An den Enden der Pedalia entspringen die Tentakel, einer bis drei bei der Ordnung Carybdeida. In der Ordnung Chirodropida inserieren die Tentakel um eine palmenförmige Struktur mit gegenständigen oder gegeneinander versetzten Tentakeln und einem unpaaren äußeren Tentakel, der am Ende eines konusförmigen Gebildes sitzt und deutlich höher als die anderen Tentakel ansetzt. Er liegt außen auf den anderen Tentakeln und verdeckt deren Ansätze, wenn man von außen auf das Pedalium blickt. Dieser Typus wird auch "compound pedalium" (zusammengesetztes Pedalium) genannt.[4] Es sind bis zu etwa 60 Tentakel vorhanden, also etwa 15 pro Pedalium. Die Tentakel sind hohl, sehr muskulös und stark kontraktil bzw. stark dehnbar. Sie sind meist sehr lang, immer deutlich länger als die Höhe des Schirms. Sie sind mit tausenden von Nesselzellen (Nematozyten oder Cnidozyten) besetzt, die die Nesselkapseln (Nematozysten oder Cnidozysten) enthalten. Die Nesselkapseln sind auf den Tentakeln meist nicht gleichmäßig verteilt, sondern zu Ringen konzentriert. Sie sind senkrecht oder leicht schräg zur Oberfläche der Tentakel angeordnet. Sie tragen unterschiedliche Typen von Nesselzellen, welche Typen wo auf den Tentakelbereichen vorkommen, ist artspezifisch und variiert entsprechend stark.
Nesselzellen

Bei den Würfelquallen wurden bisher nur Stomocniden von sechs verschiedenen Grundtypen beobachtet: drei verschiedene Haploneme (atriche, basitriche und holotriche Isorhizen) und drei verschiedene Heteroneme (mikrobasische Mastigophoren, heterotriche mikrobasische Eurytelen und Stenotelen). Allerdings gelang bei neueren Untersuchungen bereits eine weitere Unterteilung dieser sechs Typen, z. B. der Isorhizen. Die Nesselzellen entstehen in speziellen Bildungszellen, den Nematoblasten oder Cnidoblasten. Sie werden häufig als sogenannte Wanderzellen erst an den eigentlichen Ort ihrer Verwendung transportiert. Sie werden entweder einzeln zwischen den Epidermzellen eingelagert, oder zu Batterien von mehreren Nesselzellen konzentriert. Die Entladung erfolgt durch die mechanische Reizung des Cnidocils, einer aus einer Geissel hervorgegangenen starren Borste der Nesselzelle. Die Nesselzelle selber ist durch einen Verschlussdeckel (Operkulum) verschlossen. Im Inneren befinden sich ein langer aufgerollter hohler Schlauch (Faden, oder auch Nema genannt) mit einem Schaft. Nach der unterschiedlichen Form und Funktion von Schaft und Faden werden die unterschiedlichen Typen von Nesselzellen klassifiziert. Bei der mechanischen Reizung des Cnidocil explodieren die Nesselzellen und sprengen das Operkulum ab. Durch den Überdruck von 140 bar stülpen sich Schaft und Faden in etwa einer 1/250 Sekunde nach außen. Bei einigen Typen der Nesselzellen sind die Schäfte mit feinen Stiletten versehen, die dadurch sehr leicht in die Haut eindringen können, im weiteren Verlauf der Entladung nach außen klappen und den Schaft wie eine Harpune aussehen lassen. Auch der Faden ist mit feinen Dornen besetzt, die anfangs das Eindringen erleichtern, später durch Abspreizen den Faden fest im Gewebe verankern. Die Fäden geben ein Gift bzw. einen Giftcocktail in die Haut des Opfers ab, der je nach Art cytotoxische, neurotoxische, hämolytische, cardiotoxische, dermatonekrotische, immunogene und entzündende Effekte zur Folge hat.
Die gesamte Ausstattung mit verschiedenen Typen von Nesselzellen und deren Anordnung auf Schirm, Manubrium und den Tentakeln wird auch als Cnidom bezeichnet.
Sinnesorgane

Am Rand der Exumbrella, also an den Seitenflächen des Würfels bzw. Quaders sitzen perradial in Gruben vier keulen- oder kolbenförmige, relativ große Sinnesorgane, die Rhopalien. Phylogenetisch sind sie aus umgewandelten Tentakeln entstanden. Dies lässt sich auch noch während der Ontogenese beobachten. Sie sind zweischichtig aufgebaut mit einer äußeren Epidermlage und einer inneren gastrodermalen Lage. Die Rhopalia sind durch den Stielkanal mit dem Gastralraum verbunden. Insgesamt sitzen auf den Rhopalia 24 Augen,[5] je zwei Linsenaugen, zwei schlitzförmige Pigmentaugen und zwei grubenförmige Pigmentaugen sowie an der Basis des Rhopalium die Statozyste (Gleichgewichtsorgan). Die Pigmentaugen werden auch als Nebenaugen bezeichnet. Die Augen (und auch die Statozyste) sind quasi eingebettet in eine kompakte Masse aus Nervenzellen. Die Linsenaugen sind allerdings dem Schirminneren zugewandt und können nur schwarz-weiß sehen. In Laborversuchen wichen Medusen dunklen Gegenständen geschickt aus.
Im unteren Teil des Rhopalium sitzt das Gleichgewichtsorgan, die Statozyste. Sie enthält einen kompakten Statolithen, der aus Gips bzw. Bassanit[6] besteht. Er zeigt feine Anwachsringe, die als tägliche Wachstumsringe gedeutet werden.[7]
Nesselgifte und ihre Wirkung

Das Nesselgift der Würfelquallen gehört zu den stärksten Giften im Tierreich. Es dient dem Beutefang und der Verteidigung gegen Feinde. Das Gift, das sich in den Nesselkapseln der etwa 1,2 m langen Tentakel von Chironex fleckeri befindet, bewirkt den Tod eines Kindes, das damit in Berührung kommt, innerhalb weniger Minuten. Die Länge eines einzigen Tentakels eines erwachsenen Chironex fleckeri kann bis zu 3 m erreichen. Ein adultes Exemplar hat bis zu 60 Tentakel. Das Gift eines einzigen Exemplars von Chironex fleckeri könnte somit theoretisch über 100 Menschen töten.[3] Nach anderen Quellen haben sechs bis acht Meter Tentakel genügend Gift, um einen Menschen zu töten.[8] Mitte der 2010er Jahre wurde über Todesfälle von Touristen auf den thailändischen Inseln Ko Pha-ngan und Ko Samui berichtet.[9] Eine Vergiftung durch das Nesselgift einer anderen Gruppe von Würfelquallen („Irukandji-Gruppe“) löst das äußerst schmerzhafte Irukandji-Syndrom aus, das allerdings sehr selten tödlich verläuft. Bisher sind die Gifte und deren Strukturen kaum aufgeklärt, klar ist nur, dass diese aus Proteinen bestehen.
Lebenszyklus

Die Fortpflanzung kann sowohl im Polypenstadium als auch im Medusenstadium erfolgen. Im Polypenstadium wurde bisher nur die ungeschlechtliche Vermehrung durch Knospung beobachtet. Bei guter Ernährungslage des Polypen können sogar mehrere Knospen gleichzeitig gebildet werden. Sie lösen sich einzeln vom Körper des „Mutter“-Polypen ab und kriechen davon. Der Polyp nimmt ein besonderes Entwicklungsstadium ein, den Kriechpolypen. Dabei streckt sich der Polyp sehr stark und bewegt sich mit den kontrahierten Tentakeln voraus (z. B. Carybdea marsupialis). Der Kriechpolyp von Tripedalia dagegen streckt einen einzelnen Tentakel aus und trägt diesen als Suchorgan voran. Wie der Polyp sich bewegt ist bisher noch nicht geklärt. Die Kriechphase dauert etwa zwei bis drei Tage, dann heftet sich der Polyp auf einem geeigneten Festgrund an und wird zum „normalen“ Polypen, der sich wieder durch Knospung vermehren kann oder sich durch Metamorphose in eine Meduse umwandeln kann.
Im Medusenstadium kommt nur die geschlechtliche Fortpflanzung vor. Die Geschlechter sind getrennt. Die Polypen unterscheiden sich äußerlich noch nicht nach Männchen und Weibchen. Doch auch bei den Medusen sind sie wegen der Durchsichtigkeit aller Organe äußerlich kaum zu unterscheiden. Die Dauer bis zum Erreichen der Geschlechtsreife ist artspezifisch. Sie beträgt bei Tripedalia cystophora etwa zehn bis zwölf Wochen.
Die Geschlechtsprodukte, Eier und Spermien werden meist ins freie Wasser abgegeben, wo die Befruchtung erfolgt (z. B. bei Chironex fleckeri). Bei anderen Arten wurde dagegen eine innere Befruchtung beobachtet. Bei den Männchen von Tripedalia cystophora werden die Spermien zu Spermienbündeln zusammengefasst. Mehrere Spermienbündel werden in besonderen Gastraltaschen zu runden Spermatophorenkugeln gebündelt und mit einer Membran umgeben. Die Spermienübertragung erfolgt erst nach einem relativ komplexen Paarungsspiel. Erst schwimmen Männchen und Weibchen nebeneinander. Dann fängt das Männchen mit einem Tentakel den Tentakel des Weibchens, danach drehen die Partner sich im Kreis. Dabei überträgt das Männchen die Spermatophoren auf einen Tentakel des Weibchens. Die Partner trennen sich. Das Weibchen führt die Spermatophoren mit Hilfe des Tentakels zum Gastralraum. Dort löst sich die Hülle auf und die Spermien können die aus den Gonaden ausgestoßenen Eier in den Gastraltaschen befruchten. Die Gonaden werden bei der Paarung nahezu völlig entleert, können sich jedoch regenerieren und es kann zu einer weiteren Paarung kommen (zumindest unter Zuchtbedingungen).
Die befruchteten Eier entwickeln sich in den Gastraltaschen in zwei bis drei Tagen zu sogenannten Planula-Larven. Diese verlassen dann die Gastraltaschen und entwickeln sich im freien Wasser weiter (Larviparie). Nach weiteren zwei bis drei Tagen heften sie sich an einem günstigen Festgrund an und entwickeln sich zu einem Polypen. Dieser bildet zunächst nur zwei oder drei Tentakel aus und unterscheidet sich dadurch deutlich vom Primärpolypen der Schirmquallen (Scyphozoa), bei dem als erste Anlage gleich vier Tentakel entstehen.
Lebensweise
Ein abwechselndes Füllen und Entleeren ihrer Schirmhöhlung ermöglicht den Tieren eine Fortbewegung durch das Rückstoßprinzip. Es sind relativ schnelle Schwimmer, die zielgerichtet schwimmen, aber auch schnelle 180°-Wendungen durchführen können. Chironex fleckeri bewegt sich mit bis zu 414 m/h entlang der Küsten.[10] Carybdea marsupialis pulsiert 120 bis 150 mal in der Minute und legt dabei 3 bis 6 m zurück (entspricht also 180 bis 360 m/h). Sie sind in Schwimm- und Wanderungsverhalten eher mit Fischen zu vergleichen. Die in der populärwissenschaftlichen Literatur oft kolportierte „planktonische“ Lebensweise der „Quallen“ trifft auf die Würfelquallen (Cubozoa) sicher nicht zu, sie gehören zum Nekton.
Bisher sind nur wenige Arten so gut erforscht, dass man den kompletten Lebenszyklus kennt. Meist sind nur die Medusenstadien beschrieben. Die Medusen sind meist in den flachen Küstengewässern (oberes Sublitoral) anzutreffen, wo sie Fische und Krebstiere jagen. Bei der Art Chirodectes maculatus wird angenommen, dass sie wohl ein Bewohner tieferer Gewässer des Schelfes ist. Das Gleiche gilt für die Art Alatina alata, die um Neukaledonien vorkommt. Sie bewegt sich jedoch etwa alle vier Wochen zur Reproduktion an die oberste Schicht, wo sie dann eine Gefahr für Schwimmer darstellt.[11] Die Entwicklung der meisten Arten ist stark saisonal gesteuert. Im nördlichen Queensland (Australien) erscheint Chironex fleckeri im Oktober bis Dezember und verschwindet dann im April bis Mai. Die Polypen wurden inzwischen in Mangrovenkanälen großer Flussmündungen z. T. bis 15 km landeinwärts gefunden.[12] Unter Laborbedingungen wurde festgestellt, dass sie starke Schwankungen im Salzgehalt relativ gut vertragen. Die Polypen können sich asexuell vermehren bis zu Minimum-Salzgehalten um 20 Promille, sie überleben Salzgehalte von etwa fünf Promille. Die Verträglichkeit höherer Salzgehalte wurde nicht getestet, jedoch waren bei Salzgehalten um 42 Promille keine Beeinträchtigungen zu beobachten. Bisher ist kaum bekannt, wie alt die Medusen werden können. Bei kleineren Arten dürfte die Lebensdauer etwa drei bis vier Monate betragen. Da manche Arten einen jährlichen Zyklus haben und stark von den Jahreszeiten in ihrem Lebensraum beeinflusst werden, ist anzunehmen, dass die Tiere insgesamt nur ein Jahr alt werden. Dies muss für die Arten, die auf dem tieferen Schelf leben (z. B. Chirodectes maculatus) nicht zutreffen.
Die Medusen der Würfelquallen sind aktive Räuber, die sich von Zooplankton, vor allem Ruderfußkrebsen (Copepoda), Garnelen, Flohkrebsen (Amphipoda), Fischlarven und kleinen Fischen ernähren.
Geographische Verbreitung
Die meisten Arten der Würfelquallen sind Bewohner der flachen Küstengewässer tropischer und subtropischer Gewässer von Indik, Pazifik und Atlantik. Nur wenige Arten dringen auch in gemäßigte Breiten vor, so beispielsweise Carybdea marsupialis bis ins Mittelmeer und an die portugiesische Küste. Das Verbreitungsgebiet von Tamoya haplonema reicht von der Karibik bis Cape Cod (im Südosten des Bundesstaates Massachusetts, USA). Carybdea rastonii ist von der Südspitze Australiens bis nach Hokkaidō (Japan) anzutreffen. Die jeweilige Diversität in einem Meeresgebiet ist meist nicht hoch. Es kommen im selben Verbreitungsgebiet meist nur zwei bis drei Arten vor.

Fossile Würfelquallen
Die älteste allgemein anerkannte fossile Würfelqualle ist Anthracomedusa turnbulli aus dem Pennsylvanium von Illinois (USA). Zwei weitere fossile Würfelquallen, Bipedalia cerinensis und Paracarybdea lithographica, wurden 2006 aus dem Oberen Kimmeridgium (Jura) von Cerin (Dept. Ain, Frankreich) beschrieben.[13] Eine Würfelqualle aus dem Kambrium beschreiben Cartwright et al. (2007)[14] in offener Nomenklatur, das heißt ohne Vergabe von wissenschaftlichen Namen, aus dem Mittleren Kambrium der Marjum-Formation von Utah (USA). Mit der Neuinterpretation des Fossils Yunnanoascus haikouensis wurde im Jahr 2016 auch die erste Art aus der chinesischen Chengjiang-Faunengemeinschaft beschrieben; dies wäre damit die älteste Würfelqualle.[15]
Systematik
Die Würfelquallen wurden lange als Ordnung Cubomedusae in die Schirmquallen (Scyphozoa) eingereiht. Bernhard Werner (1975) stellte dann gravierende Unterschiede zu den Schirmquallen fest und errichtete daher die Klasse der Cubozoa.
Klassische Systematik
Das klassische hierarchische System hat in den letzten Jahren durch zahlreiche Neubeschreibungen und Neubearbeitungen eine starke Erweiterung und Modifikation erfahren. Erst 2010 wurde das System von Bastian Bentlage et al. modifiziert und einige neue Taxa eingeführt. Derzeit werden zwei Ordnungen unterschieden, Chirodropida und Carybdeida:
- Ordnung Chirodropida Haeckel, 1880. Bei den Chirodropida sitzen an den grundsätzlich vier Muskellappen (Pedalia), die sich an den vier Ecken des Quallenschirms befinden, immer eine größere Zahl von Tentakeln. Es sind bisher die folgenden Gattungen und Arten beschrieben worden, die auf die drei Familien Chirodropidae, Chiropsalmidae und Chiropsellidae verteilt werden:
- Familie Chirodropidae Haeckel, 1880
- Gattung Chirodectes Gershwin, 2006
- Chirodectes maculatus (Cornelius, Fenner & Hore, 2005)
- Gattung Chirodropus Haeckel, 1880
- Chirodropus gorilla Haeckel, 1880
- Chirodropus palmatus Haeckel, 1880
- Gattung Chironex Southcott, 1956
- Chironex fleckeri Southcott, 1956 (auch Seewespe genannt)
- Chironex indrasaksajiae Sucharitakul, 2017[16]
- Chironex yamaguchii Lewis & Bentlage, 2009
- Gattung †Anthracomedusa Johnson & Richardson, 1968
- †Anthracomedusa turnbulli Johnson & Richardson, 1968 (Pennsylvanium)
- Gattung Chirodectes Gershwin, 2006
- Familie Chiropsalmidae Thiel, 1936
- Gattung Chimaerus Straehler-Pohl, Ghepdeu, Chougong, Tchoumbougnang & Morandini, 2022[17]
- Chimaerus palmatus (Haeckel, 1880)
- Gattung Chiropsalmus Agassiz, 1862
- Chiropsalmus zygonema Haeckel, 1880 (nomen dubium)
- Chiropsalmus alipes Gershwin, 2006
- Chiropsalmus quadrumanus (F. Müller, 1859)
- Gattung Chiropsoides Southcott, 1956 (nomen novum pro Drepanochirus Krumbach, 1925 non Péringuey, 1901 (Käfergattung))
- Chiropsoides buitendijki (Horst, 1907)
- Chiropsoides quadrigatus (Haeckel, 1880)
- Gattung Chimaerus Straehler-Pohl, Ghepdeu, Chougong, Tchoumbougnang & Morandini, 2022[17]
- Familie Chiropsellidae Toshino, Miyake & Shibata, 2015[18]
- Familie Chirodropidae Haeckel, 1880
- Ordnung Carybdeida Gegenbaur, 1856. Die Vertreter der Carybdeida besitzen vier Muskellappen (Pedalia), mit der Ausnahme der Tripedaliidae, die zwei oder drei Pedalia pro Kante haben, also insgesamt bis zwölf Pedalia. Es ist aber immer genau ein Tentakel pro Pedalium vorhanden. Die Gastraltaschen weisen keine Divertikel auf, d. h., sie besitzen keine, in den Subumbrellarraum hineinragenden Blindsäcke. Derzeit werden der Ordnung fünf Familien zugewiesen:
- Familie Carybdeidae Gegenbaur, 1857
- Gattung Carybdea Peron & Lesueur, 1809
- Carybdea arborifera (Maas, 1897)
- Carybdea aurifera Mayer, 1900 (nomen dubium)
- Carybdea branchi Gershwin & Gibbons, 2009
- Carybdea brevipedalia (Kishinouye, 1891) (= Carybdea mora (Kishinouye, 1910))
- Carybdea grandis Agassiz & Mayer, 1902
- Carybdea latigenitalia Kishinouye, 1891 (nomen dubium ?= C. brevipedalia)
- Carybdea morandinii Straehler-Pohl & Jarms, 2011
- Carybdea murrayana Haeckel, 1880
- Carybdea marsupialis Linné, 1758 (gelegentlich auch Mittelmeer-Seewespe genannt)
- Carybdea prototypus (Haeckel, 1880)(nomen dubium)
- Carybdea rastonii Haacke, 1886
- Carybdea verrucosa Hargitt, 1903 (nomen dubium)
- Carybdea xaymacana Conant, 1897
- Gattung Copula Bentlage, Cartwright, Yanagihara, Lewis, Richards & Collins, 2010
- Copula lucentia Fonfría, Straehler-Pohl, Stampar & Bordehore, 2024[21]
- Copula sivickisi (Stiasny, 1926)
- Gattung †Paracarybdea Gaillard, Goy, Bernier, Bourseau, Gall, Barale, Buffetaut & Wenz, 2006
- †Paracarybdea lithographica Gaillard, Goy, Bernier, Bourseau, Gall, Barale, Buffetaut & Wenz, 2006
- Gattung Carybdea Peron & Lesueur, 1809
- Familie Carukiidae Bentlage, Cartwright, Yanagihara, Lewis, Richards & Collins, 2010
- Gattung Carukia Southcott, 1967
- Carukia barnesi Southcott, 1967
- Carukia shinju Gershwin, 2007
- Gattung Gerongia Gershwin & Alderslade, 2005
- Gerongia rifkinae Gershwin & Alderslade 2005
- Gattung Gershwinia Wutthituntisil, Xiao & Aungtonya, 2023
- Gershwinia thailandensis Wutthituntisil, Xiao & Aungtonya, 2023[22]
- Gattung Malo Gershwin, 2005
- Gattung Morbakka Gershwin, 2008
- Morbakka fenneri Gershwin, 2008
- Morbakka virulenta (Kishinouye, 1910)
- Gattung Carukia Southcott, 1967
- Familie Tamoyidae Haeckel, 1880
- Gattung Tamoya F. Müller, 1859
- Tamoya ancamori Straehler-Pohl, 2020[25]
- Tamoya bursaria Lesson, 1829 (nomen dubium)
- Tamoya gargantua Lesson, 1829 (nomen dubium)
- Tamoya haplonema F. Müller, 1859
- Tamoya ohboya Collins, Bentlage, Gillan, Lynn, Morandini & Marques, 2011[26]
- Gattung Tamoya F. Müller, 1859
- Familie Alatinidae Gershwin, 2005
- Gattung Alatina Gershwin, 2005
- Alatina alata (Reynaud, 1830) (nomen dubium)
- Alatina grandis (Agassiz & Mayer, 1902)
- Alatina madraspatana (Menon, 1930)
- Alatina moseri (Mayer, 1906) (= Alatina mordens Gershwin, 2005)
- Alatina obeliscus (Haeckel, 1880) (nomen dubium)
- Alatina philippina (Haeckel, 1880) (nomen dubium)
- Alatina pyramis (Haeckel, 1880) (nomen dubium)
- Alatina rainensis Gershwin, 2005
- Alatina tetraptera (Haeckel, 1880)
- Alatina turricula (Haeckel, 1880) (nomen dubium)
- Gattung Keesingia Gershwin, 2014[23]
- Keesingia gigas Gershwin, 2014[23]
- Gattung Manokia Southcott, 1967
- Manokia stiasnyi (Bigelow, 1938)
- Gattung Alatina Gershwin, 2005
- Familie Tripedaliidae Conant, 1897
- Gattung †Bipedalia Gaillard, Goy, Bernier, Bourseau, Gall, Barale, Buffetaut & Wenz, 2006.
- †Bipedalia cerinensis Gaillard, Goy, Bernier, Bourseau, Gall, Barale, Buffetaut & Wenz, 2006. im Plattenkalk von Cerin, Département Ain, Frankreich. Oberjura
- Gattung Tripedalia Conant, 1897
- Tripedalia binata Moore, 1988
- Tripedalia cystophora Conant, 1897
- Tripedalia maipoensis Sun et al., 2023[27]
- Gattung †Bipedalia Gaillard, Goy, Bernier, Bourseau, Gall, Barale, Buffetaut & Wenz, 2006.
- Ordo et Fam. indet.
- Gattung †Quadrimedusina Haeckel, 1869
- †Quadrimedusina quadrata Haeckel, 1869. im Solnhofener Plattenkalk
- Gattung †Quadrimedusina Haeckel, 1869
- Familie Carybdeidae Gegenbaur, 1857
Phylogenie
Nach der molekulargenetischen Analyse durch Collins (2002) und einer kombinierten morphologisch-molekulargenetischen Analyse von Marques & Collins (2004) sind die Würfelquallen (Cubozoa) das Schwestertaxon der Staurozoa. Beide Taxa zusammen sind wiederum das Schwestertaxon der Schirmquallen (Scyphozoa).
Einzelnachweise
- ↑ a b I . Straehler-Pohl und G. Jarms: Life cycle of Carybdea marsupialis Linnaeus, 1758 (Cubozoa, Carybdeidae) reveals metamorphosis to be a modified strobilation. Marine Biology, 147: 1271–1277, London 2005 doi:10.1007/s00227-005-0031-4
- ↑ a b Carybdea marsupialis wurde von Carl von Linné ursprünglich aus dem Mittelmeer beschrieben. Die Tiere, die von Bernhard Werner u. a. als Carybdea marsupialis bestimmt und für seine grundlegenden Arbeiten zur Biologie benutzt wurden, stammen jedoch aus Puerto Rico. Die seit 40 Jahren gehaltene Polypenkultur wurde auch für andere grundlegende Untersuchungen der Biologie der Würfelquallen benutzt. Nach den molekulargenetischen Untersuchungen 18S (small subunit) und 28S (large subunit) sowie mitochondriale 16S von Bentlage et al. ist diese Kultur sehr nahe mit Alatina spp. verwandt. Es besteht der starke Verdacht, dass diese Population nicht Carybdea marsupialis ist, sondern eine Alatina-Art. Alatina spp. kommt in Puerto Rico vor, während Carybdea marsupialis ansonsten auf das Mittelmeer beschränkt ist.
- ↑ a b Peter J. Fenner: Dangers in the Ocean: The Traveler and Marine Envenomation. I. Jellyfish. Journal of Travel Medicine, 5(3): 135–141 1998 doi:10.1111/j.1708-8305.1998.tb00487.x
- ↑ Paul F. S. Cornelius, Peter J. Fenner und Russell Hore: Chiropsalmus maculatus sp. nov., a cubomedusa from the Great Barrier Reef. Memoirs of the Queensland Museum, 51(2): 399–405, Brisbane, 2005 ISSN 0079-8835
- ↑ A. Garm, M. M. Coates, R. Gad, J. Seymour und D.-E. Nilsson: The lens eyes of the box jelly fish Tripedalia cystophora and Chiropsalmus sp. are slow and color-blind. Journal of Comparative Physiologie A, 193: 547–557, 2007 doi:10.1007/s00359-007-0211-4
- ↑ Henry Tiemann, Ilka Sötje, Alexander Becker, Gerhard Jarms und Matthias Epple: Calcium sulfate hemihydrate (bassanite) statoliths in the cubozoan Carybdea sp. Zoologischer Anzeiger - Journal of Comparative Zoology, 245(1): 13–17, München 2006 doi:10.1016/j.jcz.2006.03.001
- ↑ Shunshiro Ueno, Chifumi Imai and Atsushi Mitsutani: Fine growth rings found in statolith of a cubomedusa Carybdea rastoni. Journal of Plankton Research, 17(6): 1381–1384, Oxford 1995 ISSN 0142-7873 Abstract
- ↑ The Cubozoan -- Chironex fleckeri, abgerufen am 30. August 2021
- ↑ Thailand: Deutsche Touristin stirbt nach Würfelquallen-Stich. SpiegelOnline, 7. Oktober 2015, abgerufen am 9. Oktober 2015.
- ↑ M. R. Gordon und J. E. Seymour: Quantifying movement of the tropical Australian cubozoan Chironex fleckeri using acoustic telemetry. Hydrobiologia, 616: 87–97, Dordrecht 2009 doi:10.1007/s10750-008-9594-7
- ↑ À la recherche des cuboméduses dans les eaux calédoniennes la1ere.francetvinfo.fr, 4. Februar 2024, abgerufen am 4. Februar 2024 (französisch)
- ↑ R. F. Hartwick: Distributional ecology and behaviour of the early life stages of the box-jellyfish Chironex fleckeri. Hydrobiologia, 216/217: 181–188, Dordrecht 1991 ISSN 0018-8158 PDF
- ↑ Christian Gaillard, Jaqueline Goy, Paul Bernier, Jean Paul Bourseau, Jean Claude Gall, Georges Barale, Eric Buffetaut und Sylvie Wenz: New jellyfish taxa from the Upper Jurassic Lithographic Limestones of Cerin (France): Taphonomy and Ecology. Palaeontology, 49(6): 1287–1302, London 2006
- ↑ Paulyn Cartwright, Susan L. Halgedahl u. a.: Exceptionally Preserved Jellyfishes from the Middle Cambrian. In: PLoS ONE. 2, 2007, S. e1121, doi:10.1371/journal.pone.0001121.
- ↑ Jian Han, Shixue Hu, Paulyn Cartwright, Fangchen Zhao, Qiang Ou, Shin Kubota, Xing Wang, Xiaoguang Yang (2016): The earliest pelagic jellyfish with rhopalia from Cambrian Chengjiang Lagerstätte. Palaeogeography, Palaeoclimatology, Palaeoecology 449: 166–173. doi:10.1016/j.palaeo.2016.02.025
- ↑ Phuping Sucharitakul, Siriwadee Chomdej, Thunyaporn Achalawitkun, Isara Arsiranant: Description of Chironex indrasaksajiae Sucharitakul sp. nov. (Cnidaria, Cubozoa, Chirodopida): a new species of box jellyfish from the Gulf of Thailand. Phuket Marine Biological Centre Research Bulletin, 74: 33–44, 2017 PDF
- ↑ Straehler-Pohl, Ghepdeu, Chougong, Tchoumbougnang & Morandini (2022): Ernst Haeckel’s mysterious species, Part II: African Chirodropida (Cnidaria, Cubomedusae). In: Plankton Benthos Res. 17(4), S. 406–429.
- ↑ Sho Toshino, Hiroshi Miyake, Haruka Shibata: Meteorona kishinouyei, a new family, genus and species (Cnidaria, Cubozoa, Chirodropida) from Japanese Waters. Zookeys, 503: 1–21, 2015 doi:10.3897/zookeys.503.9047
- ↑ Bastian Bentlage: Description of the chirodropid box jellyfish Chiropsella rudloei sp. nov.(Cnidaria: Cubozoa) from Madagascar. Marine Biodiversity Records, 2013 PDF
- ↑ Lisa-Ann Gershwin, Merrick Ekins: A new pygmy species of box jellyfish (Cubozoa: Chirodropida) from sub-tropical Australia. Marine Biodiversity Records, 8, 2015, e111 (8 Seiten) doi:10.1017/S175526721500086X
- ↑ Fonfría, E. S.; Straehler-Pohl, I.; Stampar, S. N.; Collins, A. G.; Hoverd, W. A.; Bordehore, C. (2024). Copula lucentia sp. nov., a new box jellyfish (Cnidaria: Cubozoa: Carybdeida) from Western Mediterranean Sea. Marine Biodiversity. 54(5) Open Access
- ↑ N. Wutthituntisil, X. Jie, A. Charatsee, P. Jirapath, D. Usawadee, P. Rungraung, T. Natnaphat, K. Pichai, Z. Xuelei: Gershwinia thailandensis Wutthituntisil, Xiao and Aungtonya: A new Genus and Species of Box Jellyfish (Cubozoa: Carybdeida: Carukiidae) from Thai Waters. Phuket Marine Biology Center Research Bulletin, 80, 1–19, 2023 Download
- ↑ a b c Lisa-Ann Gershwin: Two new species of box jellies (Cnidaria: Cubozoa: Carybdeida) from the central coast of Western Australia, both presumed to cause Irukandji syndrome. Records of the Western Australian Museum 29 (1): 10–19, 2014 PDF
- ↑ Bastian Bentlage, Cheryl Lewis: An illustrated key and synopsis of the families and genera of carybdeid box jellyfishes (Cnidaria: Cubozoa: Carybdeida), with emphasis on the “Irukandji family” (Carukiidae). Journal of Natural History, 46(41–42): 2595–2620, 2012, doi:10.1080/00222933.2012.717645
- ↑ Ilka Straehler-Pohl: A new species found in the Collection of the Discovery Expedition from 1925–27: Tamoya ancamori sp. nov.(Cnidaria, Cubozoa, Carybdeida, Tamoyidae) from West African waters. Plankton Benthos Research, 15(3): 189–206, 2020 doi:10.3800/pbr.15.1
- ↑ Allen G. Collins, Bastian Bentlage, William Gillan, Tara H. Lynn, André C. Morandini und Antonio C. Marques: Naming the Bonaire banded box jelly, Tamoya ohboya, n. sp. (Cnidaria: Cubozoa: Carybdeida: Tamoyidae). Zootaxa, 2753: 53–68, 2011 PDF
- ↑ Yanan Sun, Justin Hon Yin Tsui, Rachel Ting Huen Wong, Ringo Nga Ching Cheung, Murphy Kam Pui Ng, Carmen K.M. Or, Jian-Wen Qiu: A New Species of Box Jellyfish (Cnidaria: Tripedaliidae: Tripedalia) from Hong Kong, China. Zoological Studies 62: 17, 2023 doi:10.6620/ZS.2023.62-17
Literatur
Auf dieser Seite verwendete Medien
Autor/Urheber: Massimiliano DE MARTINO, Lizenz: CC BY-SA 3.0
en:Carybdea marsupialis, Tyrrhenian Sea (Mediterranean), Italy
(c) Author: User Antonsusi from the German Wikipedia, CC BY 3.0 de
Inner cladogram paths for en:Cubozoa. Text is invisible ("white on white") for use with en:Template:Annotated image
Lebenszyklus einer Würfelqualle (Cubozoa)
Autor/Urheber: Brinkman DL, Aziz A, Loukas A, Potriquet J, Seymour J, Mulvenna J, Lizenz: CC BY-SA 3.0
Lichtmikroskopische Aufnahme von Nematozysten, die von Tentakeln von Chironex fleckeri (dt.: Seewespe) isoliert wurden (400 fache Vergrößerung)
(c) Author: User Antonsusi from the German Wikipedia, CC BY 3.0 de
Cladogram paths for en:Box jellyfish. Text is invisible ("white on white") for use with en:Template:Annotated image
Autor/Urheber: James St. John, Lizenz: CC BY 2.0
Anthracomedusa turnbulli Johnson & Richardson, 1968 fossil jellyfish from the Pennsylvanian of Illinois, USA (public display, FMNH PE 38977, Field Museum of Natural History, Chicago, Illinois, USA).
One of the most remarkable soft-bodied fossil deposits (lagerstätten) on Earth is the Pennsylvanian-aged Mazon Creek Lagerstätte near Chicago, Illinois. In the Mazon Creek area, the Francis Creek Shale consists of concretionary gray shales. The Francis Creek concretions are composed of argillaceous ironstone, and can be fossiliferous or nonfossiliferous. The fossiliferous concretions contain land plants and terrestrial & marine animals, including nonmineralizing organisms.
This is a rare example of a fossil cubozoan jellyfish. Cubozoans are also called “box jellyfish", in reference to their perceived subquadrate bell shape. Some of the most venomous marine animals in modern oceans include species of box jellyfish.
This specimen has been compressed perpendicular to the oral-aboral axis of the jellyfish body. The central structure is the bell. Anthracomedusa had four tufts of tentacles near the periphery of the body - those are the irregularly linear structures near the margin of the concretion.
Classification: Animalia, Cnidaria, Cubozoa, Carybdeida, Carybdeidae
Stratigraphy: Mazon Creek Lagerstätte, Francis Creek Shale Member, Carbondale Formation, Desmoinesian Stage (= Westphalian D), upper Middle Pennsylvanian
Locality: coal mine dump pile near Essex, northern Illinois, USAAutor/Urheber: Genet (Diskussion), Lizenz: CC BY-SA 4.0
Hazardous Marine Creatures (Australia)
Autor/Urheber: Kersti 14:28, 15 January 2007 (UTC), Lizenz: CC BY 2.5
Auge der Qualle (eine Cubomeduse) Carybdea marsupialis als Beispiel für ein einfaches Linsenauge
Autor/Urheber: Guido Gautsch, Melbourne, Australia, Lizenz: CC BY-SA 2.0
A box jellyfish (Chironex sp.) – tiny but dangerous – at Port of Nagoya Public Aquarium, Japan.