Triflylgruppe
Als Triflylgruppe (CF3SO2−) wird der kovalent gebundene Rest der Trifluormethansulfonsäure bezeichnet. Es handelt sich dabei meist um die Ester der Trifluormethansulfonsäure. Ihr Name leitet sich von ihrer systematischen Bezeichnung Trifluormethansulfonyl ab. Die Verbindungen werden gewöhnlich als Triflate bezeichnet und dürfen nicht mit den gleichnamigen Salzen der Trifluormethansulfonsäure (Triflate) verwechselt werden. In Strukturformeln wird die Triflylgruppe oft mit Tf abgekürzt; sie ist strukturell mit der Mesylgruppe verwandt. Die Triflatgruppe wird oft mit OTf abgekürzt und ähnelt der Mesylatgruppe.
Herstellung
Triflate können durch Deprotonierung eines Alkohols und anschließender Reaktion mit Trifluormethansulfonylchlorid hergestellt werden, wobei ein Äquivalent Chlorwasserstoff durch eine Base als Hydrochlorid gebunden wird:
Eigenschaften
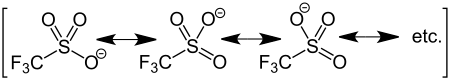
Durch die negativen induktiven Effekte der Fluoratome sind das Schwefel- sowie die Sauerstoffatome sehr elektronenarm. Zusätzlich ist das Triflation über drei Grenzstrukturen gut mesomeriestabilisiert. Dies führt dazu, dass die Trifluormethansulfonsäure eine starke Säure und somit das Triflation eine schwache Base ist, welche durch geeignete Nukleophile leicht unter Substitution abgespalten werden kann. Aus diesem Grund müssen Triflylverbindungen in Abwesenheit von Nukleophilen, beispielsweise Wasser oder Alkohole, aufbewahrt werden.
Verwendung
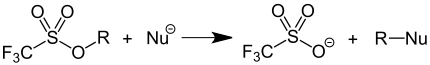
Die Triflylatgruppe ist eine ausgezeichnete Abgangsgruppe und findet als solche Anwendung in der präparativen Organischen Chemie. Durch Überführung von Alkoholen in Triflate wird die schlechte Abgangsgruppe OH− in eine gute Abgangsgruppe (CF3SO3–) überführt, wodurch Substitutionsreaktionen an dieser Position ermöglicht werden. Triflate sind hierbei bis zu 10.000 mal reaktiver als Tosylate.[1]
Diese Anwendung ist nicht besonders atomökonomisch, da stets stöchiometrische Mengen von Abfallstoffen mit vergleichsweise hoher Molekularmasse gebildet werden. Deshalb wird die Synthesemethode vorwiegend im Labormaßstab und kaum in technischen Prozessen eingesetzt.
Mit Alkoholen bilden Alkyltriflate Ether im Sinne einer Williamsonschen Ethersynthese.[2]
In Palladium-katalysierten Reaktionen wie der Suzuki- oder Sonogashira-Kupplung können Aryl- oder Alkenyltriflate anstelle der häufig eingesetzten Halogenverbindungen eingesetzt werden. Die Reihe der Reaktivität der Arylverbindungen ist hierbei:[3]
11C-markiertes Methyltriflat wird zur Einführung markierter Methylgruppen in biologischen Molekülen verwendet.[2]
Einzelnachweise
- ↑ Autorenkollektiv, Organikum, 21. Auflage, Wiley-VCH, Weinheim 2001, ISBN 3-527-29985-8, S. 217.
- ↑ a b Eintrag zu Trifluormethansulfonsäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ Autorenkollektiv, Organikum, 21. Auflage, Wiley-VCH, Weinheim 2001, ISBN 3-527-29985-8, S. 405–407.
Weblinks
Auf dieser Seite verwendete Medien
Trifluoromethylate_Substitution
Aryl-X_Relative_Reactivity
Trifluoromesylate_Anion_Mesomeric_Stabilisation
Autor/Urheber: Jü, Lizenz: CC BY-SA 4.0
Struktur der Triflylgruppe
Trifluoromesylate_Anion
Trifluoromesylate group
Trifluoromethylate_Synthesis