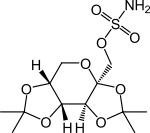
Topiramat
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Topiramat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C12H21NO8S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | N03AX11 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 339,4 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Topiramat (Handelsname: Topamax) ist ein Arzneistoff gegen Epilepsie und Migräne. Einzelberichte beschreiben einen positiven Effekt von Topiramat in der Cluster-Kopfschmerz-Prophylaxe.[3] Es wurde in Deutschland bis zum Patentablauf 2009 nur von Janssen-Cilag vertrieben.
Wirkmechanismus
Topiramat wirkt über verschiedene Mechanismen, die eine übermäßige Erregung von Nervenzellen verhindern. Topiramat blockiert die (verstärkend wirkende) Glycin-Bindungsstelle am erregenden glutamatergen AMPA-Rezeptor[4] und verstärkt durch Bindung an GABA-Rezeptoren deren hemmenden Effekt. Außerdem inaktiviert Topiramat den spannungsabhängigen Natriumkanal, wodurch die Zelle gehindert wird, schnell aufeinanderfolgende Aktionspotentiale zu generieren. Des Weiteren wirkt es modulierend auf bestimmte spannungsabhängige Calciumkanäle und bewirkt eine schwache Hemmung gewisser Isoenzyme der Carboanhydrase.
Pharmakokinetik
Topiramat wird vom Körper gut aufgenommen und wird als Tablette verabreicht. Die Halbwertszeit beträgt zwischen 20 und 30 Stunden. Topiramat wird überwiegend unverändert über die Niere ausgeschieden. Daher muss bei verminderter Nierenleistung die Dosis des Arzneimittels gesenkt werden. Durch die Antiepileptika Carbamazepin und Phenytoin wird der Topiramatspiegel im Blut gesenkt. Bei Therapiekombination mit diesen muss die Topiramatdosis angepasst werden.
Anwendung
Topiramat wird in Dosen von 25 bis 200 mg als Antiepileptikum eingesetzt. Es wird bei Erwachsenen und Jugendlichen als Zusatzmedikament bei fokalen und generalisierten Anfällen sowie beim Lennox-Gastaut-Syndrom eingesetzt. Des Weiteren ist Topiramat für die Prophylaxe von Migräne-Anfällen zugelassen. Zur Migräne-Prophylaxe werden in der Regel 50 bis maximal 100 mg des Wirkstoffes eingesetzt.[5]
Manche Patienten profitieren auch von 200 mg Topiramat pro Tag zur Migräne-Prophylaxe.[6][7]
Nach den Empfehlungen der Deutschen Migräne- und Kopfschmerz-Gesellschaft kann Topiramat auch zur vorbeugenden Behandlung von Cluster-Kopfschmerzen verwendet werden.[8] In letzter Zeit wird Topiramat auch in Bezug auf die Behandlung der chronifizierten PTBS (Posttraumatische Belastungsstörung) getestet. Hier werden erste ermutigende Ergebnisse berichtet.[9] Topiramat ist verschreibungspflichtig.
Topiramat bei Alkohol- und Kokainabhängigkeit
Die Dopaminfreisetzung im corticomesolimbischen System wird durch Topiramat reduziert, vermutlich könnte der Arzneistoff in der Therapie von Alkoholabhängigen eingesetzt werden. In einer doppelblinden, randomisierten und placebokontrollierten Studie wurde diese Behandlungsoption genauer untersucht. Während 14 Wochen erhielten 371 Probanden entweder Topiramat in steigender Dosis (bis 300 mg/Tag ab der fünften Woche) oder Placebo. Zusätzlich zur medikamentösen Therapie wurden wöchentlich kurze Einzelgespräche geführt. Werden die Tage mit starkem Alkoholkonsum betrachtet, so reduzierte sich dieser Anteil in der Topiramat-Gruppe von 81,5 % auf 43,8 % und in der Placebo-Gruppe von 82 % auf 51,8 %. In der Topiramat-Gruppe kam es häufiger zu Nebenwirkungen wie zum Beispiel Parästhesien, Geschmacks- oder Konzentrationsstörungen. Die Autoren der Studie sehen in Topiramat eine vielversprechende Therapieoption bei Alkoholabhängigkeit. Es müssen noch verschiedene Parameter wie zum Beispiel Dosierung und Wirkdauer abgeklärt werden.[10][11]
Einer doppelblinden placebokontrollierten Studie der Universität von Pennsylvania zufolge erhöht Topiramat die Wahrscheinlichkeit, abstinent von Kokain zu bleiben, sowie die Wahrscheinlichkeit, eine dreiwöchige Abstinenzzeit zu erzielen, gegenüber Placebo deutlich.[12] Eine weitere Studie kam zum Schluss, dass Topiramat das Verlangen nach Kokain bei 25 % der Teilnehmer deutlich senken kann.[13]
Anwendung in der Schwangerschaft und Stillzeit
Topiramat hat bei Maus, Ratte und Kaninchen teratogene Wirkungen gezeigt. Daten aus Schwangerschaftsregistern (Nordamerikanisches Antiepileptika-Schwangerschaftsregister, NAAED, sowie das Epilepsie- und Schwangerschaftsregister des Vereinigten Königreichs) zeigten Fälle von schwerwiegenden Fehlbildungen des Kindes, wenn die Mutter im ersten Schwangerschaftstrimenon Topiramat eingenommen hatte. Ebenso weisen präklinische Daten auf ein teratogenes Potential des Arzneistoffs hin. In Deutschland wurde ein Stufenplanverfahren eingeleitet.[14] Für die Behandlung der Migräne darf Topiramat in der Schwangerschaft nicht eingenommen werden. Topiramat wird in der Milch säugender Ratten ausgeschieden. Begrenzte Beobachtungen beim Menschen weisen auf einen erheblichen Übertritt in die Muttermilch hin.[15] Im September 2022 hat der europäische Pharmakovigilanzausschuss (PRAC) auf Antrag Frankreichs mit einer Überprüfung Topiramat-haltiger Arzneimittel bezüglich des Risikos neurologischer Entwicklungsstörungen bei Kindern begonnen, deren Mütter in der Schwangerschaft Topiramat eingenommen haben.[16] Frankreich verschärfte 2022 die Verschreibungs- und Abgabebedingungen für Topiramat: Künftig muss die Erstverordnung von Topiramat für Mädchen und Frauen im gebärfähigen Alter durch einen Neurologen oder einen Kinderarzt erfolgen, die zudem mindestens einmal jährlich die Notwendigkeit der Behandlung überprüfen müssen. Dabei ist jedes Mal von den Fachärzten und den Frauen (bzw. bei Minderjährigen deren Erziehungsberechtigten) ein Aufklärungsbogen zu unterschreiben, der in der Apotheke bei jeder Rezepteinlösung vorgelegt werden muss. Im Falle einer Schwangerschaft darf Topiramat Frauen mit Epilepsie in Frankreich nur noch verordnet werden, wenn alle anderen Behandlungsoptionen nicht ausreichen oder nicht vertragen werden. Keinesfalls soll eine bestehende antiepileptische Therapie bei Kinderwunsch oder Schwangerschaft jedoch ohne ärztliche Rücksprache abgesetzt werden. Als Antiepileptika der Wahl in der Schwangerschaft werden in Deutschland sowie in Großbritannien Lamotrigin und Levetiracetam empfohlen.[17]
Im September 2023 hat der Sicherheitsausschuss (PRAC) der Europäischen Arzneimittelagentur (EMA) weitere Empfehlungen zusammengestellt, um die Topiramat-Exposition ungeborener Kinder im Mutterleib zu verhindern. Für Frauen, die Topiramat zur Behandlung von Epilepsie verwenden, rät der PRAC nun, das Arzneimittel während der Schwangerschaft generell nicht anzuwenden, es sei denn, es steht keine andere geeignete Behandlung zur Verfügung. Gibt es bei Frauen im gebärfähigen Alter keine weiteren Optionen zur Pharmakotherapie, bleibt es – wie zuvor schon bekannt – dabei, mit verlässlichen Methoden zu verhüten.[18]
Anwendung von Topiramat und Empfängnisverhütung
Patientinnen, die neben Topiramat gleichzeitig orale Kombinationskontrazeptiva („Antibabypille“) einnehmen, müssen mit einer möglichen Verminderung der empfängnisverhütenden Wirksamkeit sowie mit verstärkten Durchbruchblutungen rechnen. Die Verhütungssicherheit der Antibabypille kann durch Topiramat auch beeinflusst werden, ohne dass es zu Durchbruchblutungen kommt.[15] Anders als bislang in deutschen (und in französischen) Fach- und Gebrauchsinformationen wird in der Risikoinformation explizit darauf hingewiesen, dass zur Empfängnisverhütung eine Methode zu bevorzugen ist, die von der Anwenderin nicht beeinflusst werden kann, beispielsweise ein Intrauterinpessar (IUP). Alternativ sind zwei verschiedene Kontrazeptiva zu verwenden, darunter eine Barrieremethode. In Großbritannien werden wegen möglicher enzyminduzierender Effekte von Topiramat ausschließlich Kupfer- oder Levonorgestrel-haltige IUPs sowie Depot-Medroxyprogesteronazetat plus Kondom empfohlen. Unbedingt auch die Ausführungen unter Schwangerschaft und Stillzeit (s. o.) beachten.[17][18]
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Topiramat wirkt auf das Zentralnervensystem. Es können Schläfrigkeit, Schwindel oder andere ähnliche Symptome auftreten. Dies kann insbesondere dann gefährlich werden, wenn die Patienten ein Fahrzeug lenken oder Maschinen bedienen müssen.[15]
Nebenwirkungen
Topiramat kann folgende Nebenwirkungen haben:
- Verlust und fehlender Geschmackssinn, bis hin zu Entzündungen im Mundbereich.
- klingelndes Geräusch im Ohr, bis hin zu Ohrenschmerzen.
- vermindertes Sehvermögen.
- häufigste Nebenwirkung sind Kribbelempfindungen, besonders in Armen und Beinen (sogenannte Parästhesien); diese verschwinden jedoch in der Regel nach einiger Zeit; eine kaliumreiche Ernährung (Bananen, Trockenobst) kann die Parästhesien lindern
- Ataxie (Koordinationsstörung, z. B. stark schwankender Gang) – kann gleichzeitig zu sehr langsamem Gehen trotz Gehhilfe (auch wenn vor Einnahme von Topiramat keine Gehilfe benötigt wurde) führen
- Konzentrationsstörungen (mitten im Satz weiß man nicht mehr, was man sagen wollte. Suche nach Worten)
- Kopfschmerzen
- Gestörte Merkfähigkeit (betrifft sowohl das Kurz- als auch das Langzeitgedächtnis)
- das Gefühl, Erlerntes nicht mehr zu können
- erhöhte Reizbarkeit
- (Depression)
- (Schlafstörungen,) Albträume
- (Appetitsteigerung,) Appetitverminderung (wird daher auch bei Essstörungen eingesetzt)
- (Zittern der Hände)
- skandierende Sprache bzw. Redeweise, was vom Betroffenen nicht wahrgenommen wird
- Auftreten von sogenannten dissoziativen Anfällen, Wutanfällen
- Halluzinationen
Sollte der Verdacht bestehen, dass z. B. starke Gangstörungen die Wirkung von Topiramat sind, muss dies mittels geeigneter Tests geprüft werden.
Weblinks
Einzelnachweise
- ↑ Eintrag zu TOPIRAMATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c Datenblatt Topiramate bei Sigma-Aldrich, abgerufen am 24. April 2011 (PDF).
- ↑ S1-Leitlinie Clusterkopfschmerz und trigeminoautonome Kopfschmerzen der Deutschen Gesellschaft für Neurologie (DGN). In: AWMF online (Stand 2015).
- ↑ H. Lüllmann, K. Mohr, L. Hein: Pharmakologie und Toxikologie. Thieme, 2006.
- ↑ Herstellerinformation Glenmark (pdf)
- ↑ Gelbe Liste Online: Topiramat - Anwendung, Wirkung, Nebenwirkungen | Gelbe Liste. Abgerufen am 15. März 2023.
- ↑ Topiramat-Fachinformation. 1. Januar 2006, abgerufen am 15. März 2023.
- ↑ A. May, S. Evers, G. Brössner, T. Jürgens, A. R. Gantenbein, V. Malzacher, A. Straube: Leitlinie zur Diagnostik, Therapie und Prophylaxe von Cluster-Kopfschmerz, anderen trigemino-autonomen Kopfschmerzen, schlafgebundenem Kopfschmerz und idiopathisch stechenden Kopfschmerzen. Überarbeitete Therapieempfehlungen der Deutschen Migräne- und Kopfschmerzgesellschaft in Zusammenarbeit mit der DGN, ÖKSG, SKG. In: Nervenheilkunde. (Memento vom 20. August 2016 im Internet Archive) 35(3), 2016, S. 137–151; DMKG.de (PDF; 328 kB)
- ↑ Jeffrey L. Berlant: Prospective open-label study of add-on and monotherapy topiramate in civilians with chronic nonhallucinatory posttraumatic stress disorder. In: BMC Psychiatry. Band 4, Nr. 1, August 2004, S. 24, doi:10.1186/1471-244X-4-24 (biomedcentral.com).
- ↑ Topiramate for Treating Alcohol Dependence. In: JAMA. 298, 2007, S. 1641–1651.
- ↑ Antiepileptikum mildert Alkoholabhängigkeit. (Memento vom 27. Februar 2017 im Internet Archive) auf: aerzteblatt.de, 10. Oktober 2007.
- ↑ K. M. Kampman, H. Pettinati, K. G. Lynch, C. Dackis, T. Sparkman, C. Weigley, C. P. O’Brien: A pilot trial of topiramate for the treatment of cocaine dependence. In: Drug Alcohol Depend. Band 75, Nr. 3, 2004, S. 233–240, PMID 15283944.
- ↑ A. D. Reis, L. A. Castro, R. Faria, R. Laranjeira: Craving decrease with topiramate in outpatient treatment for cocaine dependence: an open label trial. In: Rev Bras Psiquiatr. Band 30, Nr. 2, 2008, S. 132–135, PMID 18470406.
- ↑ Topiramat: Hinweise auf erhöhtes Risiko für Fehlbildungen bei Anwendung im ersten Trimenon. (Memento vom 10. Februar 2013 im Webarchiv archive.today) Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), 16. Mai 2012.
- ↑ a b c Fachinformation Topamax. Januar, Janssen-Cilag GmbH, Stand 2011.
- ↑ PRAC starts review of topiramate use in pregnancy and women of childbearing potential. Abgerufen am 22. Oktober 2022.
- ↑ a b CAVE TOPIRAMAT (TOPAMAX, GENERIKA) IN DER SCHWANGERSCHAFT ... Verordnungsbeschränkungen in Frankreich. Abgerufen am 22. Oktober 2022.
- ↑ a b Meeting highlights from the Pharmacovigilance Risk Assessment Committee (PRAC) 28-31 August 2023, PM der EMA vom 1. September 2023, abgerufen am 4. September 2023
Auf dieser Seite verwendete Medien
Topiramate
