Toluylsäuren
| Toluylsäuren | ||||
| Name | 2-Toluylsäure | 3-Toluylsäure | 4-Toluylsäure | |
| Andere Namen | o-Toluylsäure 2-Methylbenzoesäure | m-Toluylsäure 3-Methylbenzoesäure | p-Toluylsäure 4-Methylbenzoesäure | |
| Strukturformel |  |  | 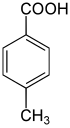 | |
| CAS-Nummer | 118-90-1 | 99-04-7 | 99-94-5 | |
| PubChem | 8373 | 7418 | 7470 | |
| Summenformel | C8H8O2 | |||
| Molare Masse | 136,15 g·mol−1 | |||
| Aggregatzustand | fest | |||
| Kurzbeschreibung | gelbe Schuppen[1] | gelbliche Schuppen mit schwach aromatischem Geruch[2] | weißes kristallines Pulver mit schwach aromatischem Geruch[3] | |
| Schmelzpunkt | 101–104 °C[1] | 110–111 °C[2] | 179–181 °C[3] | |
| Siedepunkt | 260 °C[1] | 263 °C[2] | 274 °C[3] | |
| pKs-Wert | 3,91[4] | 4,27[4] | 4,37[4] | |
| Löslichkeit in Wasser | 1,2 g·l−1 (25 °C)[1] | 1 g·l−1 (20 °C)[2] | 0,3 g·l−1 (20 °C)[3] | |
| GHS- Kennzeichnung |
| |||
| H- und P-Sätze | 315‐319‐335 | 315‐319‐335 | 302‐319 | |
| keine EUH-Sätze | keine EUH-Sätze | keine EUH-Sätze | ||
| 261‐305+351+338 | 261‐280‐302+352 305+351+338 | 305+351+338 | ||
Die Toluylsäuren (oder Methylbenzoesäuren) bilden in der Chemie eine Stoffgruppe, die sich sowohl von der Benzoesäure als auch vom Toluol ableitet. Die Struktur besteht aus einem Benzolring mit angefügter Carboxy- (–COOH) und Methylgruppe (–CH3) als Substituenten. Durch deren unterschiedliche Anordnung ergeben sich drei Konstitutionsisomere (ortho, meta oder para) mit der Summenformel C8H8O2. In erster Linie sind sie als methylsubstituierte Benzoesäuren anzusehen.
Eigenschaften
Die Isomere der Toluylsäure sind farblose bis gelbliche Feststoffe. Die Schmelzpunkte unterscheiden sich charakteristisch.
Das elektronenstoßinduzierte Massenspektrum von 2-Toluylsäure einerseits unterscheidet sich signifikant von jenen der beiden anderen Stellungsisomere, da über den ortho-Effekt die Abspaltung von Wasser aus dem Molekülion begünstigt ist.[5]
Darstellung
Aus den Xylol-Isomeren erhält man durch Sauerstoff-Oxidation (z. B. in Gegenwart von Cobalt(II)-stearat als Katalysator) die entsprechenden Toluylsäuren. Bei dieser von Ewald Katzschmann entdeckten Reaktion wird selektiv nur eine Methylgruppe oxidiert.[6] In einem Xylol-Isomerengemisch wird das para-Isomer vor den anderen Isomeren oxidiert.
Verwendet man stärkere Oxidationsmittel wie Kaliumpermanganat oder Chromschwefelsäure, so werden beide Methylgruppen oxidiert.
Literatur
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 118-90-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. März 2017. (JavaScript erforderlich)
- ↑ a b c d e Eintrag zu CAS-Nr. 99-04-7 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. März 2017. (JavaScript erforderlich)
- ↑ a b c d e Eintrag zu CAS-Nr. 99-94-5 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 7. März 2017. (JavaScript erforderlich)
- ↑ a b c CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ Jürgen Martens, Klaus Praefcke und Helmut Schwarz: Massenspektrometrische Untersuchungen über ortho-Effekte und verwandte Umlagerungen bei Benzoe- und 2,2'-Diphensäurederivaten, in: Liebigs Ann. Chem., 1975, S. 62–74 (doi:10.1002/jlac.197519750107).
- ↑ E. Katzschmann: Ein Verfahren zur Oxidation von Alkylaromaten, in: Chemie Ingenieur Technik 1966, 38, 1–10. doi:10.1002/cite.330380102
Siehe auch
Auf dieser Seite verwendete Medien
3-Methylbenzoesäure; m-Toluylsäure; 3-Toluylsäure
4-Methylbenzoesäure; p-Toluylsäure; 4-Toluylsäure
2-Methylbenzoesäure; o-Toluylsäure; 2-Toluylsäure



