Thioamide

Thioamide (auch Thiosäureamide oder Thionamide) leiten sich von Amiden (genauer: Carbonsäureamiden) ab, deren Carbonylsauerstoff-Atom durch ein Schwefelatom ersetzt wurde.[1] Die Thioamide sind mesomeriestabilisiert.
Synthese
Das gebräuchlichste Verfahren zur Synthese von Thiosäureamiden beruht auf der Addition von Schwefelwasserstoff an Nitrile:[1]
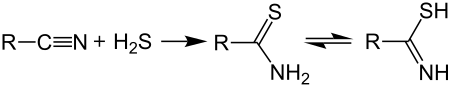
Die Synthese gelingt auch im Niederdruckverfahren, in Anwesenheit von Triethylamin.[2] Nach dieser Methode sind allerdings nur Thioamide erhältlich, die am Stickstoffatom zwei Wasserstoffatome tragen. Zur Synthese höher substituierter Thioamide geht man von Amiden aus und setzt diese mit dem Lawessons Reagenz oder Phosphorpentasulfid in einem inerten Lösungsmittel um:

Reaktivität
Die präparativ wichtigste Reaktion der Thiosäureamide besteht in der Synthese zahlreicher Heterocyclen, z. B. von Thiazolen.[1]
Vertreter
Hemmer der Hormonproduktion in der Schilddrüse:
Herbizide:
- Chlorthiamid
Einzelnachweise
- ↑ a b c Alfons Schöberl und Annemarie Wagner in Houben-Weyl Methoden der Organischen Chemie, herausgegeben von Eugen Müller, Otto Bayer, Hans Meerweis und Karl Ziegler, Band 9, Schwefel-, Selen und Tellur-Verbindungen, Thieme Verlag, Stuttgart, 1955, dort S. 762–771.
- ↑ Kleine Synthese-Ecke. Abgerufen am 31. Juli 2018 (deutsch).
Auf dieser Seite verwendete Medien
Thionamide_Gruppe
Synthese von Thionamiden
Autor/Urheber: Jürgen Martens, Lizenz: CC BY-SA 3.0
Thionamide via Lawesson-Reagenz


