Sulfide
Als Sulfide werden in der Anorganischen Chemie Verbindungen von Metallen mit Schwefel bezeichnet, die in Analogie zu den Oxiden durch Redoxreaktionen direkt aus den Elementen hergestellt werden können. Dabei wirkt der Schwefel als Oxidationsmittel in Analogie zum Sauerstoff bei der Herstellung von Oxiden. Metalloxide und Metallsulfide sind in der Mineralogie wichtige Gruppen von Erzen. In der Analytik gehören die Metallsulfide in die sogenannte Schwefelwasserstoffgruppe und in die Ammoniumsulfidgruppe.[1]
In Lehrbüchern der Organischen Chemie finden sich Bezeichnungen von schwefelhaltigen Verbindungen als Sulfide nicht und sollten auch nicht verwendet werden, besonders nicht als ungenaue Sammelbegriffe. Das gilt erst recht dann, wenn es sich wie z. B. beim sogenannten Allylmethylsulfid eindeutig um einen Thioether handelt, den man auch als Allylmethylthioether bezeichnen könnte.
Die Alkyl- und Arylderivate des Schwefelwasserstoffs (H2S) sollten nicht als Alkyl- bzw. Arylsulfide bezeichnet werden. Diese organischen Verbindungen (organischer Rest: R–) sind keine Salze und haben die Struktur R–S–R' bzw. R–S–H. Sie müssen deshalb genauer als Thioether bzw. als Thiole oder als Mercaptane bezeichnet werden.
Schwieriger ist die Lage im Fall von organischen Verbindungen, die als Disulfide bezeichnet werden und in der Biochemie der Proteine eine große Rolle spielen. Weil die Funktionelle Gruppe dieser Verbindungen die Bezeichnung Disulfide trägt, wird diese Bezeichnungen in die Bezeichnung der betreffenden Verbindung übernommen.
Sulfidische Minerale


Zusammen mit Metall- oder Halbmetall-Kationen entstehen die etwa 600 Sulfid-Minerale, die sich meist durch charakteristische Farben und Strichfarben auszeichnen. Zu ihnen gehören eine Reihe wichtiger Erzminerale, so dass anorganische Sulfide wegen ihres mitunter hohen Metallgehalts als Rohstoffe bei der Gewinnung u. a. von Eisen, Kupfer, Blei, Zink, Quecksilber, Arsen und Antimon dienen. Hier einige sulfidische Minerale:
- Bornit (Buntkupferkies, Cu5FeS4)
- Chalkopyrit (Kupferkies, CuFeS2)
- Cinnabarit (Zinnober, HgS)
- Covellin (Kupferindig, CuS)
- Galenit (Bleiglanz, PbS)
- Markasit (Strahlkies, FeS2)
- Molybdänit (Molybdänglanz, MoS2)
- Pyrit (Schwefelkies, Katzengold, Narrengold, FeS2)
- Pyrrhotin (Magnetkies, FeS)
- Realgar (Rauschrot, AsS)
- Sphalerit (Zinkblende, ZnS)
- Stibnit (Antimonglanz, Grauspießglanz, Sb2S3)
Das chemische Element Schwefel bildet, analog dem in der gleichen Hauptgruppe des Periodensystems stehenden Sauerstoff, das zweifach negativ geladene Sulfid-Anion S2−.
Die Sulfide der Alkali- und Erdalkalimetalle können durch Anlagerung von Schwefel an freie Sulfidelektronenpaare auch Polysulfide bilden. Schwermetallsalze bilden mit Sulfid-Lösungen unlösliche Niederschläge – eine Eigenschaft, die man für die Analytische Chemie im Kationentrenngang nutzt.
Polymetallische Sulfide, die an Hydrothermalquellen der Tiefsee entstehen, könnten in Zukunft eine Rohstoffquelle für verschiedene wertvolle und seltene Metalle darstellen. Deutschland hat 2013 eine Lizenz zum Abbau maritimer Rohstoffe im Indischen Ozean bei Madagaskar beantragt.[2]
Chemische Eigenschaften
In Analogie zu den Oxiden, die auch als Salze der sehr schwachen Säure Wasser aufgefasst werden können, sind die Metallsulfide auch auffassbar als Salze der schwachen Schwefelwasserstoffsäure, deren Anhydrid der gasförmige Schwefelwasserstoff ist. Bei den Sulfiden, mit dem Sulfid-Anion S2−, ist das gasförmige Anhydrid Schwefelwasserstoff leicht aus den Metallsulfiden zu erzeugen und am üblen Geruch erkennbar, wenn sich nach Zugabe von stärkeren oder starken Säuren das Metallsulfid auflöst. Bei den Metalloxiden ist eine analog ablaufende Reaktion mit Säuren unter Bildung von Wasser nicht am Geruch erkennbar und deshalb nur dann bemerkbar wenn sich das Oxid auflöst, was nur selten der Fall ist.
In wässriger Lösung liegen Sulfid-Ionen zumeist als Hydrogensulfid-Anionen (HS−) vor. Gemäß 2018 veröffentlichten Untersuchungen mit Raman-Spektroskopie ist das in wässriger Lösung lange postulierte Anion S2− nicht existent.[3]
Die Schwefelwasserstoffsäure ist in wässriger Lösung eine schwache Säure. Diese Eigenschaft wird unter anderem im Kationentrenngang in der Schwefelwasserstoff- und Ammoniumsulfidgruppe eingesetzt, da die pH-Wert-abhängige Sulfidionenkonzentration eine sukzessive Fällung der unterschiedlich löslichen Sulfide ermöglicht.
Zur Schwefelwasserstoffgruppe gehören nämlich nur diejenigen Elemente, deren Kationen mit dem Trennmittel H2S schon in saurem Milieu schwerlösliche Sulfide bilden (Fällungsreaktion; Sulfid-Beispiele im Bild rechts, von links nach rechts: Niederschläge mit Mangan(II)-, Cadmium(II)-, Kupfer(II)-, Zink(II)-, Antimon(III)-, Bismut(III)-, Blei(II)- und Zinn(IV)-Kationen). Zur Ammoniumsulfidgruppe gehören die nur im basischen Milieu ausfällbaren Metallsulfide. Sie sind bei Zugabe von Säuren löslich (s. o.). Neben den Sulfiden gibt es noch die ihnen verwandten Thio- und Sulfosalze. Hier sind Sauerstoffatome gegen Schwefelatome ausgetauscht worden (Beispiel: Natriumthiostannat und -thioantimonat, Natriumthiosulfat/Fixiersalz).
Nachweis
Sulfid-Ionen (S2−) lassen sich mit Bleiacetatpapier nachweisen, wobei eine schwarze Färbung des Papiers eintritt, hervorgerufen von Bleisulfid:
- Sulfid-Ionen reagieren mit Blei(II)-acetat zu schwarzem Blei(II)-sulfid und Acetat-Ionen.
Eine weitere Möglichkeit ist das Ansäuern einer festen Probe mit einer starken Säure. Es entsteht ein charakteristischer Geruch nach faulen Eiern, hervorgerufen durch das Gas Schwefelwasserstoff, welches mit der Säure aus dem Sulfid verdrängt werden kann. Der Geruch erinnert auch allgemein an Fäulnis, da Schwefelwasserstoff auch bei Stoffwechselvorgängen schwefel„atmender“ (sulfatreduzierender oder schwefelreduzierender) Mikroben entstehen kann.
- Sulfid-Ionen reagieren mit Wasserstoff-Ionen zu dem Gas Schwefelwasserstoff (ähnlicher Geruch wie faule Eier).
Mit Nitroprussid-Natrium bildet sich in schwach alkalischer Lösung eine violette Lösung von [Fe(CN)5NOS]4−.[4]
Verwendung
Sulfidische Metallfällung

Die chemische Fällung von Metallsulfiden spielt nicht nur bei den technischen Herstellungsprozessen eine Rolle, beispielsweise bei der Herstellung von Pigmenten, sondern auch bei Abwasserreinigungsprozessen. Dabei wird die geringe Löslichkeit der Metallsulfide genutzt, um möglichst geringe Metall-Restkonzentrationen zu erzielen. Meist sind Sulfide wesentlich geringer löslich als Hydroxide, beispielsweise: Bleisulfid, Cadmiumsulfid, Eisensulfid, Kupfersulfid, Nickelsulfid, Silbersulfid oder Zinksulfid. Als sulfidisches Fällungsmittel wird in der Regel Natriumsulfid oder Natriumhydrogensulfid verwendet.
Mechanische und sonstige Anwendungen
Fein gemahlene Metallsulfide wie Molybdän(IV)-sulfid und Zinn(IV)-sulfid[5] werden, teils gemischt mit Graphit, als Festschmierstoff in Schmiermitteln für die Verbesserung der Notlaufeigenschaften von beweglichen Teilen in Maschinen eingesetzt. Auf Blei(II)- und Antimon(III)-sulfid wird hierbei aufgrund von zumindest vermuteten umwelt- und gesundheitsgefährdenden Eigenschaften zunehmend verzichtet. Des Weiteren finden sich Metallsulfide in Brems- und Kupplungsbelägen[5] sowie als Bestandteil von Schleifmitteln. Ferner kommen sie als funktionelle Additive unter anderem in Kunststoffen, Sintermetallen und Batterien zum Einsatz.
Organische Sulfide
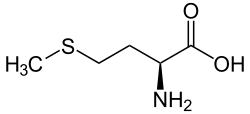
Viele Geruchsstoffe natürlicher Aromen sind organische Sulfide wie beispielsweise in Kaffee. Die natürliche Aminosäure Methionin ist ein Sulfid. Racemisches DL-Methionin wird als Futtermittelzusatzstoff im technischen Maßstab hergestellt.
Zu organischen Sulfiden siehe Thioether.

Aus dem Urin des Rotfuchses (Vulpes vulpes) ist mit Methyl-(3-methylbut-3-enyl)-sulfid ein organisch-chemisches Sulfid isoliert worden.[6]
Bedeutung für die Umwelt
Sulfide spielen bei der Entstehung von sauren Bergbauwässern eine wichtige Rolle. Saure Bergbauwässer entstehen, wenn die in den Gesteinen anwesenden sulfidischen Mineralien oxidierenden Bedingungen ausgesetzt werden. Die Eisensulfide, die in den Bergbaugebieten am häufigsten vorkommen, sind Pyrit (FeS2) und Markasit (FeS2). Während die abiogene Oxidation bei üblichen Temperaturen und Drücken sehr langsam vonstattengeht, sind biologische Prozesse üblicherweise für den größten Teil der anfallenden Säuren verantwortlich. Hierbei oxidieren aerobe Mikroorganismen Sulfid zu Sulfat, wobei Schwefelsäure entsteht. Beim Management von Tagebaurestlöchern – vor allem aus dem Braunkohletagebau, welcher oft in sulfidhaltigen Schichten stattfindet – muss entsprechend Sorge getragen werden, dass kein Luftsauerstoff zutritt (schnelle Flutung) oder dass eine einmal erfolgte Entstehung von Säuren durch Zugabe alkalischer Stoffe (Kalk, Rotschlamm o. ä.) ausgeglichen wird.
Zudem haben Eisensulfidmineralien nach der Theorie von Günter Wächtershäuser bei der Entstehung des Lebens eine Rolle gespielt (chemische Evolution).
Siehe auch
Literatur
- D. Weismann, M. Lohse (Hrsg.): Sulfid-Praxishandbuch der Abwassertechnik; Geruch, Gefahr, Korrosion verhindern und Kosten beherrschen! 1. Auflage, VULKAN-Verlag, 2007, ISBN 978-3-8027-2845-7.
- Tatjana Hildebrandt, Manfred K. Grieshaber: Tödlich und doch lebensnotwendig: Die vielen Seiten des Sulfids. In: Biologie in unserer Zeit. 39, Nr. 5, 2009, S. 328–334, doi:10.1002/biuz.200910403.
- Halbach, Peter: Erstentdeckung von Massivsulfiden in einem intrakontinentalen Back-arc-Becken. Die Geowissenschaften, 7(6), 157–161, 1989, doi:10.2312/geowissenschaften.1989.7.157
Weblinks
Einzelnachweise
- ↑ Theodore L. Brown, H. Eugene LeMay, Chemie. Ein Lehrbuch für alle Naturwissenschaftler| VCH VerlagsgesellschaftD6940 Weinheim, 1988, ISBN 3-527-26241-5, S. 716
- ↑ Deutschland will Metalle im Indischen Ozean suchen, ORF.at vom 29. Dezember 2013.
- ↑ P. M. May, D. Batka, G. Hefter, E. Königsberger and D. Rowland: Goodbye to S2− in aqueous solution. Chem. Commun., 2018, 54, 1980–1983.
- ↑ Jander/Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie, 5. Auflage, S. Hirzel, Stuttgart-Leipzig 1965, S. 130.
- ↑ a b Patent DE19815992C2: Festschmierstoffe auf Basis von Zinnsulfid und Kohlenstoff. Angemeldet am 9. April 1998, veröffentlicht am 14. September 2000, Anmelder: Chemetall Ges.mbH, Erfinder: Ronald Hüner et al.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 228, ISBN 978-3-906390-29-1.
Auf dieser Seite verwendete Medien
Autor/Urheber: Johannes Schneider, Lizenz: CC BY-SA 4.0
Mit Ammoniumsulfid gefällte Niederschläge von Antimon, Mangan, Chrom, Arsen und Cadmium.
Strukturformel von Methyl-(3-Methylbut-3-enyl)-sulfid Quelle: Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich, 2006, S. 228, ISBN 978-3-906390-29-1.
(c) DerHexer, Wikimedia Commons, CC-by-sa 4.0
Harvard Museum of Natural History. Stibnite. (Iyo) Ehime, Shikoku, Japan.
Autor/Urheber: Ra'ike (see also: de:Benutzer:Ra'ike), Lizenz: CC BY 3.0
Pyritwürfel im Muttergestein - aufgenommen auf einer Mineralbörse
Struktur von L-Methionin






