Silberfärbung
Die Silberfärbung bezeichnet ein Verfahren zum Anfärben von Proteinen, Kohlenhydraten, DNA und RNA in Polyacrylamid-Gelen nach einer Elektrophorese oder in Dünnschnitten von Geweben.
Geschichte
Das Verfahren basiert auf der Entwicklung von Fotografien. Diese entwickelte sich im 19. Jahrhundert aus den Photogrammen Thomas Wedgwoods, gefolgt von der Daguerreotypie und der Kalotypie.[2] Camillo Golgi verwendete ab 1873 die Golgi-Färbung unter dem Namen „la reazione nera“ (auf deutsch ‚die schwarze Reaktion‘) zur Kontrastierung des Nervensystems in Gewebeschnitten, später wurde sie auch als Golgi-Methode bekannt.[3][4]
Anwendungen

Moleküle in biologischen Geweben, die verstärkt Silberionen binden, werden als argyrophil bezeichnet. Daneben gibt es noch argentaffine Moleküle, die Silberionen binden und auch reduzieren können.
Histologie
Heute werden zur Silberfärbung von Geweben unter anderem noch die Methenamin-basierten Silberfärbungen nach Grocott (bei verschiedenen Pilzen),[5] nach Gömöri,[6] nach Warthin-Starry (färbt Spirochaeten, Helicobacter pylori, Lawsonia intracellularis, Microsporidia)[7][8][9][10][11] nach Dieterle (färbt Bartonella henselae, Treponema pallidum und Mycobacterium tuberculosis)[12] oder nach Jones (färbt Basalmembranen bei der Diagnostik der Glomerulonephritis) verwendet.[13]
Bei einer Von-Kossa-Färbung werden die Silberionen durch Phosphate ausgefällt.[14] Durch anschließende Reduktion mit Hydrochinon entsteht schwarzbraunes, elementares Silber. Damit kann die Entstehung von Hydroxyapatit z. B. in Osteoblasten angefärbt werden.
Biochemie
Die Silberfärbung von Proteinen in Agarose-Gelen wurde 1973 von Kerenyi and Gallyas entwickelt[15] und seither für Polyacrylamid-Gele optimiert,[16][17][18][19][20] und auch für die Färbung von DNA oder RNA.[21] Die Glykosylierungen von Glykoproteinen und Polysacchariden können durch einstündige Vorbehandlung mit einer 0,1 %-Lösung von Periodsäure bei 4 °C oxidiert werden, sodass die Einlagerung von Silberionen verbessert werden kann.[22]
Zunächst werden die Proteine durch eine Fixierlösung aus 10 % Eisessig und 30 % Ethanol im Gel denaturiert und fallen aus, gleichzeitig wird das Detergens (meist SDS) entfernt. Die Diffusion der Proteine ist damit deutlich reduziert. Nach mehrmaligem Waschen mit Wasser wird das Gel in einer Silbernitratlösung inkubiert. Dabei lagern sich Silberionen an negativ geladene Seitenketten der Proteine an. Überschüssiges Silber wird anschließend mit Wasser abgewaschen. Bei dem abschließenden Entwicklungsschritt werden die Silberionen durch Zugabe von alkalischem Formaldehyd zu elementarem Silber reduziert. Dieses färbt die Stellen, an denen Proteine vorhanden sind, schwarz.
Die Intensität der Färbung hängt von der Primärstruktur des Proteins ab. Weiterhin beeinflusst die Sauberkeit der verwendeten Gefäße und die Reinheit der Reagenzien die Silberfärbung.[23] Häufige Artefakte sind Banden von Keratin im Bereich von 54 bis 57 kDa und von 65 bis 68 kDa,[24] das als Kontamination der Probe in der Elektrophorese mitaufgetrennt wurde.
Diese Methode zeichnet sich durch ihre hohe Sensitivität im Vergleich zu coomassiegefärbten Gelen oder anderen Proteinfärbungen aus. Die Nachweisgrenze liegt bei 0,1 ng bis 1 ng pro Bande.
Argyrie
Die Argyrie ist eine Erkrankung, welche durch regelmäßige Einnahme von Silbersalzen oder Silberkolloiden entstehen kann und sich in einer Graufärbung der Haut, Nachtblindheit und Nierenversagen äußern kann.
Literatur
- Gold and Silver Staining: Techniques in Molecular Morphology. In: Gerhard W. Hacker, Jiang Gu (Hrsg.): Advances in Pathology, Microscopy, & Molecular Morphology. CRC Press, Boca Raton 2002, ISBN 1-4200-4023-5 (englisch, 264 S., eingeschränkte Vorschau in der Google-Buchsuche).
Einzelnachweise
- ↑ E. Hempelmann, O. Götze: Characterization of membrane proteins by polychromatic silver staining. In: Hoppe Seyler's Z Physiol Chem. Band 365, 1984, S. 241–242.
- ↑ T. Wedgwood, H. Davy: An account of a method of copying paintings upon glass and making profiles by the agency of light upon nitrate of silver, invented by T. Wedgwood, Esq., with observations by H. Davy. In: Journal of the Royal Institution. Band 1, Nr. 9, London, 22. Juni 1802.
- ↑ G. Grant: How the 1906 Nobel Prize in Physiology or Medicine was shared between Golgi and Cajal. In: Brain Res Rev. Band 55, Nr. 2, Oktober 2007, S. 490–498, doi:10.1016/j.brainresrev.2006.11.004, PMID 17306375.
- ↑ C. Golgi: Sulla struttura della sostanza grigia del cervello. In: Gazzetta Medica Italiana (Lombardia). Band 33, 1873, S. 244–246.
- ↑ R. G. Grocott: A stain for fungi in tissue sections and smears using Gomori's methenamine-silver nitrate technic. In: American journal of clinical pathology. Band 25, Nummer 8, August 1955, S. 975–979, ISSN 0002-9173. PMID 14398663.
- ↑ G. Gömöri: A new histochemical test for glycogen and mucin. In: American Journal of Clinical Pathology. (1946), Band 16, S. 177.
- ↑ A. S. Warthin, A. C. Chronister: A more rapid and improved method of demonstrating spirochetes in tissues (Warthin and Starry’s cover-glass method). In: American Journal of Syphilis. 4, 1920, S. 97–103.
- ↑ B. Huerta, A. Arenas, L. Carrasco, A. Maldonado, C. Tarradas, A. Carbonero, A. Perea: Comparison of diagnostic techniques for porcine proliferative enteropathy (Lawsonia intracellularis infection). In: Journal of comparative pathology. Band 129, Nummer 2–3, 2003 Aug-Oct, S. 179–185, ISSN 0021-9975. PMID 12921724.
- ↑ A. S. Field, D. J. Marriott, M. C. Hing: The Warthin-Starry stain in the diagnosis of small intestinal microsporidiosis in HIV-infected patients. In: Folia parasitologica. Band 40, Nummer 4, 1993, S. 261–266, ISSN 0015-5683. PMID 7516907.
- ↑ A. Slodkowicz-Kowalska: [Laboratory diagnostics of human microsporidiosis]. In: Wiadomo?ci parazytologiczne. Band 50, Nummer 4, 2004, S. 679–689, ISSN 0043-5163. PMID 16862802.
- ↑ H. G. Liu: Warthin-starry silver method showing particulate matter in macrophage. In: Biomedical and environmental sciences : BES. Band 21, Nummer 1, Februar 2008, S. 85–89, ISSN 0895-3988. doi:10.1016/S0895-3988(08)60011-2. PMID 18478983.
- ↑ J. G. Brady u. a.: Detection of mycobacterial infections using the Dieterle stain. In: Pediatr Dev Pathol. Band 1, Nr. 4, S. 309–313, PMID 10463293.
- ↑ P. A. Jones: A glutaraldehyde-dichromate-silver sequence for differentiating norepinephrine cells from epinephrine cells in neonatal and adult rats–paraffin sections. In: Stain technology. Band 42, Nummer 1, Januar 1967, S. 1–6, ISSN 0038-9153. PMID 4166282.
- ↑ L. F. Bonewald, S. E. Harris, J. Rosser, M. R. Dallas, S. L. Dallas, N. P. Camacho, B. Boyan, A. Boskey: von Kossa staining alone is not sufficient to confirm that mineralization in vitro represents bone formation. In: Calcified tissue international. Band 72, Nummer 5, Mai 2003, S. 537–547, ISSN 0171-967X. doi:10.1007/s00223-002-1057-y. PMID 12724828.
- ↑ L. Kerenyi, F. Gallyas: Über Probleme der quantitativen Auswertung der mit physikalischer Entwicklung versilberten Agarelektrophoretogramme. In: Clin. Chim. Acta. Band 47, Nr. 3, 1973, S. 425–436, doi:10.1016/0009-8981(73)90276-3, PMID 4744834.
- ↑ C. R. Merril, R. C. Switzer, M. L. Van Keuren: Trace polypeptides in cellular extracts and human body fluids detected by two-dimensional electrophoresis and a highly sensitive silver stain. In: Proc Natl Acad Sci U S A. 76(9), 1979, S. 4335–4339. PMID 92027.
- ↑ R. C. Switzer, C. R. Merril, S. Shifrin: A highly sensitive silver stain for detecting proteins and peptides in polyacrylamide gels. In: Anal Biochem. Band 98, Nr. 1, September 1979, S. 231–237, doi:10.1016/0003-2697(79)90732-2, PMID 94518.
- ↑ T. Rabilloud u. a.: Improvement and simplification of low-background silver staining of proteins by using sodium dithionite. In: Electrophoresis. 9(6), 1998, S. 288–291. PMID 2466660.
- ↑ T. Rabilloud: A comparison between low background silver diammine and silver nitrate protein stains. In: Electrophoresis. 13, 1992, S. 429–439. PMID 1425556.
- ↑ C. Lelong, M. Chevallet, S. Luche, T. Rabilloud: Silver staining of proteins in 2DE gels. In: Methods Mol Biol. 519, 2009, S. 339–350. PMID 19381593.
- ↑ H. Blum, H. Beier, H. J. Gross: Improved silver staining of plant protein, RNA & DNA in PAA gels. In: Electrophoresis. 8, 1987, S. 93–99.
- ↑ G. Dubray, G. Bezard: A highly sensitive periodic acid-silver stain for 1,2-diol groups of glycoproteins and polysaccharides in polyacrylamide gels. In: Anal. Biochem. 119(2), 1982, S. 325–329. PMID 6176144.
- ↑ E. Hempelmann, M. Schulze, O. Götze: Free SH-groups are important for the polychromatic staining of proteins with silver nitrate. In: V. Neuhof (Hrsg.): Electrophoresis. Verlag Chemie, Weinheim 1984, S. 328–330.
- ↑ D. Ochs: Protein contaminants of sodium dodecyl sulfate-polyacrylamide gels. In: Analytical biochemistry. Band 135, Nummer 2, Dezember 1983, S. 470–474, PMID 6197906.
Auf dieser Seite verwendete Medien
Autor/Urheber: Nephron, Lizenz: CC BY-SA 3.0
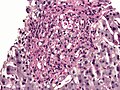
Micrograph showing histoplasmosis in a granuloma. Liver biopsy. Gomori's Methenamine Silver (GMS) stain.
Histoplasma = clumps of black circles. Granuloma = large circle with big clumps of histoplasma in it.
Related images
-
PAS-D.
-
PAS-D.
-
PAS-D.
-
GMS.
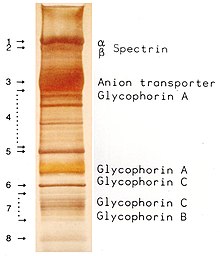
SDS PAGE of the major proteins found in the erythrocyte membrane.
Autor/Urheber: See above., Lizenz: CC BY 2.0
Clusters of bacteria (indicated by an arrow) shown on Warthin–Starry staining.