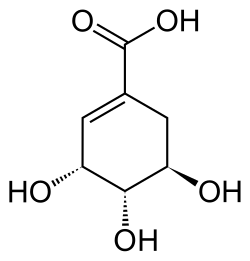
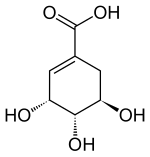
Shikimisäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Shikimisäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C7H10O5 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 174,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| pKS-Wert | 4,15 (14,1 °C)[3] | ||||||||||||||||||
| Löslichkeit | 180 g·l−1 in Wasser (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Shikimisäure ist ein biochemisches Intermediat im Stoffwechsel von Pflanzen und Mikroorganismen bei der Biosynthese von aromatischen Aminosäuren. Das Naturprodukt ist die (3R,4S,5R)-Shikimisäure. Die anderen sieben möglichen Stereoisomere der Shikimisäure haben keine biologische Bedeutung.
Geschichte
Shikimisäure wurde erstmals 1885 von Johan Fredrik Eykman aus dem Japanischen Sternanis (Illicium anisatum) isoliert, der auf Japanisch Shikimi (シキミ, bzw. in Kanji 樒, 櫁 oder 梻) heißt.[6][7]
Gewinnung und Darstellung
Shikimisäure ist ein Zwischenprodukt in der Biosynthese der für den Menschen essentiellen aromatischen Aminosäuren L-Tyrosin, L-Tryptophan und L-Phenylalanin bei Pflanzen und Mikroorganismen. Ihre Salze heißen Shikimate.
Die Shikimisäure ist ein Stoffwechselzwischenprodukt der Pflanzen und daher weit verbreitet. Sie kommt in großen Mengen in der giftigen Shikimifrucht sowie im verwandten, aber ungiftigen Sternanis vor.
Von der Shikimisäure leiten sich zahlreiche in Pflanzen vorkommende Aromaten ab, zum Beispiel die Protocatechusäure. Ein anderer Weg führt zu Gallussäure, die Bestandteil der hydrolisierbaren Gerbstoffe ist.
Shikimisäureweg
Der Shikimisäureweg stellt einen wichtigen Weg für die Biogenese von Aromaten dar.[8] Der Shikimisäureweg findet jedoch nicht in höheren Tieren statt.
Der Shikimisäureweg beginnt eigentlich nicht mit der Shikimisäure. Die Biosynthese beginnt mit der Reaktion von D-Erythrose-4-phosphat mit Phosphoenolpyruvat (PEP). Erst in weiteren Schritten entstehen dann Dehydrochinasäure, Dehydroshikimisäure, Shikimisäure und Chorisminsäure. Bei Chorismat teilt sich die Biosynthese dann in zwei Wege. In dem einen Weg entsteht L-Tryptophan, in dem anderen über Prephenat als Zwischenstufe L-Tyrosin und L-Phenylalanin. Der Shikimisäureweg ist nicht nur für den Proteinaufbau in Pflanzen wichtig, ausgehend von der beim Shikimisäureweg gebildeten α-Aminosäure, sondern auch für die Biosynthese der Cumarin-Derivate und Flavonoide.
Anwendung
Aus Shikimisäure wird in einer neunstufigen Synthese Oseltamivir, der Wirkstoff des Grippemedikaments Tamiflu®, hergestellt. Der lange Syntheseweg, der über gefährliche Azide führt, die geringe Gesamtausbeute von etwa 35 Prozent und die aufwändige Gewinnung des Rohstoffs Shikimisäure aus dem chinesischen Sternanis erschweren es derzeit, Oseltamivir in höheren Mengen zu produzieren.[9] Seit einiger Zeit kann Shikimat jedoch auch mittels rekombinanten E. coli-Stämme synthetisiert werden.[10]
Stereoisomere
Natürliche Shikimisäure besitzt die (3R,4S,5R)-Konfiguration. Die anderen sieben Stereoisomere [(3S,4R,5S)-, (3R,4R,5S)-, (3S,4S,5R)-, (3R,4S,5S)-, (3S,4R,RS)-, (3S,4S,5S)- und die (3R,4R,5R)-Shikimisäure] besitzen keine praktische Bedeutung. Das Racemat aus (3R,4S,5R)- und (3S,4R,5S)-Shikimisäure besitzt einen Schmelzpunkt von 191 bis 192 °C.[4]
Weblinks
Einzelnachweise
- ↑ Eintrag zu SHIKIMIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- ↑ a b Datenblatt (-)-Shikimic acid, 98% bei Alfa Aesar, abgerufen am 19. Juni 2019 (Seite nicht mehr abrufbar).
- ↑ a b Eintrag zu Shikimisäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Dezember 2014.
- ↑ a b The Merck Index, 9. Auflage, 1976, ISBN 0-911910-26-3, S. 1097.
- ↑ a b Datenblatt Shikimic acid, ≥99% bei Sigma-Aldrich, abgerufen am 19. Juni 2019 (PDF).
- ↑ Eykman, J. F. (1885). In: Recl. Trav. Chim. Pays-Bas. Bd. 4, S. 32.
- ↑ Jiang, S. und Singh, G. (1998): Chemical synthesis of shikimic acid and its analogues. In: Tetrahedron, Bd. 54, S. 4697.PDF ( vom 27. September 2007 im Internet Archive)
- ↑ Shikimisäure-Biosynthese (englisch)
- ↑ Hoffmann-La Roche:Factsheet Tamiflu ( vom 22. Februar 2016 im Internet Archive) (PDF; 336 kB), Stand 17. November 2006.
- ↑ Tamiflu-Produktion sichern Pharmazeutische Zeitung Ausgabe 48/2005, abgerufen am 25. September 2018.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances