Rubidiumnitrat
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
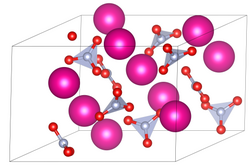 | ||||||||||||||||
| _ Rb+ _ N3+ _ O2− | ||||||||||||||||
| Kristallsystem | trigonal | |||||||||||||||
| Raumgruppe | P31 (Nr. 144) | |||||||||||||||
| Gitterparameter | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Rubidiumnitrat | |||||||||||||||
| Verhältnisformel | RbNO3 | |||||||||||||||
| Kurzbeschreibung | Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 147,47 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 3,11 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | leicht in Wasser (500 g·l−1)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Rubidiumnitrat ist das Rubidiumsalz der Salpetersäure.
Darstellung (Herstellung)
Rubidiumnitrat kann durch Salzbildungsreaktion mit Salpetersäure aus Rubidiumhydroxid oder auch aus elementarem Rubidium hergestellt werden:
Eigenschaften

Rubidiumnitrat bildet bei Raumtemperatur farblose, stark hygroskopische trigonale Kristalle und ist gut wasserlöslich. Der Brechungsindex der Kristalle beträgt nD = 1,524.[3]
| Gitterkonstanten der Modifikationen von Rubidiumnitrat | ||||||||
| Bezeichnung | Temperaturbereich [°C] | Kristallsystem | Raumgruppe | a [pm] | b [pm] | c [pm] | β | Z |
|---|---|---|---|---|---|---|---|---|
| RbNO3 – IV[1][4] | < 164 | trigonal | P31 (Nr. 144) | 1047 | - | 745 | – | 4 |
| RbNO3 – III[5][4] | 164 – 220 | kubisch | Pm3m (Nr. 221) | 440 | - | - | – | 1 |
| RbNO3 – II[4][6] | 220 – 291 | rhombisch | R3m (Nr. 160) | 548 | - | 1071 | – | |
| RbNO3 – I[7][8] | > 291 | kubisch | Fm3m (Nr. 225) | 732 | - | - | – | 4 |
Es weist eine rotviolette Flammenfärbung auf. Es ist ein starkes Oxidationsmittel und zersetzt sich beim Erhitzen zu Rubidiumnitrit und Sauerstoff:
Wenn man Rubidiumnitrat mit Salpetersäure behandelt, bilden sich die sauren Nitrate RbH(NO3)2 (Schmelzpunkt 62 °C) und RbH2(NO3)3 (Schmelzpunkt 39–46 °C).[9]
Verwendung
Entgegen anderslautender Meinungen wird Rubidiumnitrat nicht als Farbgeber in Feuerwerk verwendet.[10] Rubidiumnitrat wird als Bestandteil von infrarot-emittierenden Leuchtmitteln zusammen mit anderen Alkalinitraten als Oxidationsmittel eingesetzt.[11] Diese finden insbesondere im militärischen Bereich Verwendung, zum Beispiel in Form von Infrarot-Tarnnebeln und Infrarot-Flares.[10]
Einzelnachweise
- ↑ a b Jutta Pohl, Dieter Pohl, Gunadi Adiwidjaja: Phase Transition in Rubidium Nitrate at 346 K and Structure at 296, 372, 413 and 437 K. In: Acta Crystallographica Section B. B48, 1992, S. 160–166, doi:10.1107/S0108768191013459 (Open Access).
- ↑ a b c d e f g Datenblatt Rubidium nitrate bei Sigma-Aldrich, abgerufen am 14. Oktober 2023 (PDF).
- ↑ Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale. 4. Auflage. Band 3. Springer, 1997, ISBN 978-3-540-60035-0, S. 690 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c R. N. Brown, A. C. McLaren: The Thermal Transformations in Solid Rubidium Nitrate. In: Acta Crystallographica. Band 15, 1962, S. 974–976, doi:10.1107/S0365110X62002583 (Open Access).
- ↑ M. Shamsuzzoha, B. W. Lucas: Single-Crystal (Neutron) Diffraction Structure of III-Rubidium Nitrate. In: Acta Crystallographica Section C. C43, 1987, S. 385–388, doi:10.1107/S0108270187095660 (Open Access).
- ↑ V. I. Nasirov, U. G. Asadov, А. F. Haziyeva, F. G. Magerramova: Kinetics of IV->III Polymorphous Transformation in Rb0,95Cs0,05NO3 Single Crystals. In: Fizika (Baku). Band 15, Nr. 4, 2009, S. 27–29 (gov.az [PDF; 206 kB]).
- ↑ K. O. Strømme: On the Crystal Structures of the High-temperature Phases of Rubidium Nitrate, Cesium Nitrate, and Thallium Nitrate. In: Acta Chemica Scandinavica. Band 25, Nr. 1, 1971, S. 211–218, doi:10.3891/acta.chem.scand.25-0211.
- ↑ J. Liu, C.-G. Duan, M. M. Ossowski, W. N. Mei, R. W. Smith, J. R. Hardy: Molecular Dynamics Simulation of Structural Phase Transitions in RbNO3 and CsNO3. In: Journal of Solid State Chemistry. Band 160, Nr. 1, August 2001, S. 222–229, doi:10.1006/jssc.2001.9226.
- ↑ R. Abegg, F. Auerbach: Handbuch der anorganischen Chemie. Band 2. S. Hirzel Verlag, 1908, S. 435 (archive.org).
- ↑ a b Koch, Ernst-Christian: Special Materials in Pyrotechnics Part 2. Application of Caesium and Rubidium Compounds in Pyrotechnics. In: Journal of Pyrotechnics 2002, S. 9–24.
- ↑ Patent DE69333292: Komprimierbare Infrarot-Beleuchtungszusammensetzungen. Veröffentlicht am 13. Mai 2004, Erfinder: Daniel B. Nielson.
Auf dieser Seite verwendete Medien
Solubilité de RbNO3 dans l'eau en fonction de la température.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Autor/Urheber: Speedpera, Lizenz: CC BY 4.0
Elementarzelle der Modifikation IV von Rubidiumnitrat (RbNO3). Erstellt mit VESTA. Quelle der Kristallstruktur: doi:10.1107/S0108768191013459



