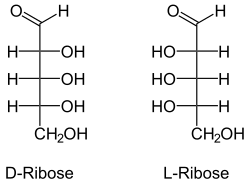
Ribose
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||
| Fischer-Projektion, offenkettige Darstellung | ||||||||||
| Allgemeines | ||||||||||
| Name | Ribose | |||||||||
| Andere Namen | ||||||||||
| Summenformel | C5H10O5 | |||||||||
| Kurzbeschreibung | farbloser Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 150,13 g·mol−1 | |||||||||
| Aggregatzustand | fest | |||||||||
| Dichte | 0,80 g·cm−3 (20 °C)[1] | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit | löslich in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Ribose (kurz: Rib) ist ein Zucker mit fünf Kohlenstoff-Atomen, eine Pentose, und kommt als D-Ribose in der Natur häufig vor, während die enantiomere L-Ribose nur geringe Bedeutung hat.
Mit „Ribose“ ist gewöhnlich D-Ribose gemeint. Von dieser unterscheidet sich die D-Desoxyribose in Desoxyribonukleinsäure (DNA) nur am C2-Atom durch ein fehlendes Sauerstoffatom. Über den Pentosephosphat-Zyklus kann Ribose auch im menschlichen Organismus aus anderen Monosacchariden synthetisiert werden.
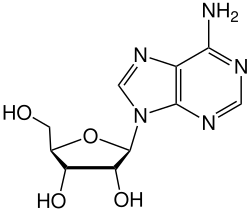
D-Ribose ist Bestandteil der Bausteine von Ribonukleinsäure (RNS/RNA). In den Nukleosiden ist die Ribose über das C1-Atom mit einer Nukleobase verknüpft, so in Adenosin, Cytidin, Guanosin, Uridin und Ribothymidin. Durch zusätzliche Phosphorylierung der Hydroxygruppe (-OH) am C5-Atom entstehen die entsprechenden Nukleotide. Das Rückgrat (Backbone) eines RNA-Makromoleküls bilden die über Phosphorsäureester-Bindungen miteinander verknüpften Ribose-Einheiten.
Eigenschaften
Ribose ist ein farbloser Feststoff mit einem Schmelzpunkt bei 90–95 °C und ist in Wasser löslich.[1]
Die Konstitution und Strukturen der D-Ribose wurden über eine Kristallstrukturanalyse aufgeklärt. Erst im Jahre 2010 konnte man mittels Röntgenbeugungs- und NMR-spektroskopischer Methoden zeigen, dass die Moleküle in kristalliner D-Ribose ein Halbacetal bilden und als Sechserring in einer Pyranoseform vorliegen. Es existieren zwei isomere Formen, α-D-Ribopyranose und β-D-Ribopyranose, welche im Kristall in unterschiedlichen Verhältnissen enthalten sind.[2]
In Wasser gelöst behält Ribose die Pyranosestruktur zum Teil bei; außerdem werden – wie schon seit langem bekannt – in einem chemischen Gleichgewicht Fünferringe, d. h. Furanosen gebildet. In beiden Fällen sind α- und β-anomere Formen möglich.
Bei 31 °C liegt das D-Ribose-Molekül zu 58,5 % in der β-D-pyranoiden, zu 21,5 % in der α-D-pyranoiden, zu 13,5 % in der β-D-furanoiden, zu 6,5 % in der α-D-furanoiden und zu 0,05 % in der offenkettigen Form vor.[3] In wässriger Lösung ist somit die β-Pyranoseform am häufigsten, da hier drei der vier Hydroxygruppen in äquatorialer Ebene liegen.
| D-Ribose – Schreibweisen | ||
|---|---|---|
| Keilstrichformel | Haworth-Schreibweise | |
 |  α-D-Ribofuranose |  β-D-Ribofuranose |
 α-D-Ribopyranose |  β-D-Ribopyranose | |
Biologische Bedeutung und Biosynthese

D-Ribose ist, am C5-OH mit Phosphorsäure verestert, als Ribose-5-phosphat ein Glied des Kohlenhydratstoffwechsels. Seine Biosynthese erfolgt auf mehreren Wegen. Eine Vorstufe ist Ribulose-5-phosphat, eine andere Glycerinaldehyd-3-phosphat, welches mit einem C2-Fragment in einer Transketolase-Reaktion zum C5-Zuckerphosphat erweitert wird.[4]
Ribose ist ein Baustein der Nukleoside und Nukleotide. Ribosyl-Nukleosidphosphate spielen eine wichtige Rolle im Stoffwechsel von Zellen, beispielsweise als biologische Energieträger wie Adenosindiphosphat (ADP) und Adenosintriphosphat (ATP). Die Wirkung hormoneller und nervöser Signale in der Zelle kann durch cyclisches Adenosinmonophosphat (cAMP), das als sekundärer Botenstoff dient, verstärkt werden.
Interstellares Vorkommen
In Meteoriten wurde im Jahre 2019 Ribose nachgewiesen.[5] Da dieses Kohlenhydrat für das Leben auf der Erde essenziell ist, stellt dieser Befund ein weiteres Mal die Frage nach der Chemischen Evolution, d. h. wie sich das präbiotische "Leben" auf unserem Planeten entwickelt hat.
Verwendung
Herzleistung
Ein Versuch am Klinikum Großhadern unter der Leitung von Dr. Wolfgang Pliml belegte die Wirkung von D-Ribose bei Infarktpatienten und Patienten mit eingeschränkter Herzfunktion. Dabei zeigte sich eine Verbesserung der Herzleistung sowie ein deutlicher Anstieg der ATP-Produktion.[6][7]
Nachweis
Ribose lässt sich mit dem Bial-Reagenz nachweisen (einer Lösung von Orcin und Eisen(III)-chlorid in konzentrierter Salzsäure). Der Test ist positiv, wenn sich nach Zugabe von Bial-Reagenz zum Kohlenhydrat und nach Erhitzen eine grün-blaue Färbung einstellt. Außerdem lässt sich Ribose durch die Molisch-Probe nachweisen.[8]
Geschichte
Der bedeutende Chemiker Emil Fischer erkannte, dass es neben den aus fünf Kohlenstoffatomen bestehenden Kohlenhydraten Xylose und Arabinose noch ein weiteres Isomer (Epimer) geben müsse, dem er den Namen Ribose gab. Dieser ist ein Kunstname, kombiniert aus vertauschten Buchstaben des Namens Arabinose.
Der aus den USA in Fischers Berliner Institut gekommene Forscher Phoebus Levene stellte die Weiche für eine in die Zukunft führende Schiene, was er damals jedoch nicht absehen konnte: Er hydrolysierte aus Bäckerhefe "Hefenucleinsäure" und erhielt eine Ribose mit D-Konfiguration. Das Ergebnis wurde im Jahre 1909 in den Berichten der deutschen chemischen Gesellschaft beschrieben.[9]
Weitere Untersuchungen von Levene und W. A. Jacobs ergaben, dass der Zucker Ribose an heterocyclische Basen, z. B. Adenin, gebunden war, d. h. als Nukleosid vorlag. Wie oben beschrieben, sind an die Nukleoside Phosphat-Gruppen gebunden (Nukleotide).
Zur Herstellung größerer Mengen Ribose waren jedoch Levenes Verfahren zu aufwendig. Hellmut Bredereck erarbeitete verbesserte Methoden, indem er ein Enzym aus Süßmandeln zur Hydrolyse einsetzte. So konnte die Reaktionstemperatur abgesenkt werden.[10][11]
Synthesen
Eine Partialsynthese von L-Ribose, ausgehend von der aus Gummi arabicum durch Hydrolyse erhältlichen L-Arabinose, wurde erstmals 1891 von Oskar Piloty und Emil Fischer beschrieben.[12] Die Aldehydgruppe der LArabinose wird mit Bromwasser zur L oxidiert. Durch Erhitzen mit Pyridin in wässriger Lösung tritt die Epimerisierung am C2-Atom ein, so dass man ein Gleichgewichtsgemisch der L-Arabonsäure mit der L erhält. Diese wird abgetrennt und zum Lacton cyclisiert, welches im letzten Schritt mittels Natriumamalgam zur L-Ribose reduziert wird.

Die Reinigung der L-Ribose nach der Reduktion mit Natriumamalgam wurde durch Willem Alberda van Ekenstein und Jan Johannes Blanksma verbessert.[13] Nachdem auch D-Arabinose durch Wohl-Abbau der billigen D-Glucose zugänglich geworden war, stellten van Ekenstein und Blanksma auch D-Ribose nach der Fischer-Piloty-Methode her.[14]
Otto Ruff veröffentlichte im Jahre 1898 eine zweite Methode zur Umwandlung der D-Gluconsäure in D-Arabinose (Ruff-Abbau). Dabei wird das Calciumsalz der Carbonsäure (Calcium-D-gluconat) mit Wasserstoffperoxid in Gegenwart von Eisensalzen oxidativ decarboxyliert.[15]
Eine wichtige Verbesserung der Synthese des D-Epimers war die elektrochemische Oxidation der D-Arabinose an der Anode unter Zusatz von Calciumcarbonat. Die D-Arabonsäure kann als Calciumsalz isoliert und weiterverarbeitet werden.[16]
Paul Karrer und Mitarbeiter nutzten diese Reaktionsschritte für eine Synthese des Lactoflavins.[17]
In neuerer Zeit ist auch die L-Ribose wieder ins Blickfeld gerückt, da Derivate dieser Pentose für die Entwicklung von pharmazeutischen Wirkstoffen interessant sein könnten. So kann durch Biotechnologie aus L-Arabinose L-Ribose hergestellt werden (vgl. mit Pilotys Synthese, siehe oben).[18]
Zuckerfaltung

D-Ribofuranose hat auch (ebenso wie ihre Desoxyform) biologisch als strukturelle Komponente von Nukleinsäuren Bedeutung. Ihr Furanosering liegt in den Nukleosiden nicht planar vor, sondern in einer gefälteten Struktur (sugar pucker). Dabei liegen entweder drei Atome (Twist-Form) oder vier Atome (Envelope-Form) des Fünfrings annähernd in einer Ebene. Je nachdem, ob das aus der Ebene herausgehobene Ring-Atom auf derselben Seite steht wie der Kohlenstoff in Position 5' oder aber entgegengesetzt, unterscheidet man endo- und exo-Konformationen. Bevorzugte Faltungen sind die C3'-endo-Konformation („Nord“-Form) und die C2'-endo-Konformation („Süd“-Form), da sie einen niedrigen Energiezustand haben. Die Konformationen sind jedoch nicht statisch, sondern können über Zwischenformen ineinander übergehen (puckering). Die verschiedenen Formen lassen sich durch das ursprünglich für Cyclopentan entworfene Modell der Pseudorotation charakterisieren. Substituenten am Furanosegerüst beeinflussen die Zuckerfaltung. Die Zuckerfaltung hat Einfluss auf die Nukleinsäure-Sekundärstruktur. Ribofuranose tritt in RNA typischerweise in einer C3'-endo-Konformation auf. 2-Desoxyribofuranose (Desoxyribose) liegt in der A-DNA in der C3'-endo-Konformation und in der B-DNA in der C2'-endo-Konformation vor.[19]
Weblinks
Einzelnachweise
- ↑ a b c d e f Eintrag zu CAS-Nr. 50-69-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 11. September 2014. (JavaScript erforderlich)
- ↑ Dubravka Šišak, L. B. McCusker, G. Zandomeneghi, B. H. Meier, D. Bläser, R. Boese, W. B. Schweizer, R. Gylmour, J. D. Dunitz. Die Kristallstruktur von D-Ribose – endlich! In: Angewandte Chemie, Jg. 2010, Bd. 122, 4605; Angewandte Chemie International Edition, Jg. 2010, Bd. 49, 4503. doi:10.1002/ange.201001266. Zitat aus dem Abstrakt: „Besser spät als nie! Die in unzähligen Biomolekülen erscheinende Furanose-Form von D-Ribose kommt nicht in der kristallinen Verbindung vor.“
- ↑ Stephen J. Angyal: The Composition of Reducing Sugars in Solution. In: Advances in Carbohydrate Chemistry and Biochemistry. Jg. 1984, Band 42, S. 15–68, doi:10.1016/S0065-2318(08)60122-5.
- ↑ Peter Karlson et al., Kurzes Lehrbuch der Biochemie für Mediziner und Naturwissenschaftler, 13. Aufl., 1988, S. 218–230, Thieme, Stuttgart, New York.
- ↑ Yoshihiro Furukawa, Yoshito Chikaraishi, Naohiko Ohkouchi, O. Ogawa, Daniel P. Glavin, Jason P. Dworkin, Chiaki Abe, Tomoki Nakamura: Extraterrestrial ribose and other sugars in primitive meteorites, In: PNAS Jg. 2019, Bd. 116, S. 24440–24445; https://www.pnas.org/content/116/49/24440
- ↑ W. Pliml, T. von Arnim, A. Stäblein, H. Hofmann, H. G. Zimmer, E. Erdmann: Effects of ribose on exercise-induced ischaemia in stable coronary artery disease. In: The Lancet. Band 340, Nr. 8818, 29. August 1992, S. 507–510, doi:10.1016/0140-6736(92)91709-h, PMID 1354276.
- ↑ Zucker in die Pumpe. In: Der Spiegel. 27. September 1992 (spiegel.de [abgerufen am 14. April 2025]).
- ↑ Hanne Rautenstrauch, Anne Rebenstorff, Steffen Gudenschwager, Klaus Ruppersberg: Ein sicherer Kohlenhydratnachweis: Die neue Molischprobe für den Unterricht. In: Chemie in unserer Zeit. 30. Mai 2022, S. ciuz.202100036, doi:10.1002/ciuz.202100036.
- ↑ P. A. Levene, W. A. Jacobs. Berichte der deutschen chemischen Gesellschaft, Jg. 1909, Bd. 42, 1201.
- ↑ Hellmut Bredereck: Darstellung der Nucleoside durch enzymatische Hydrolyse der Hefenucleinsäure; zugleich ein Beitrag zur Darstellung der d-Ribose. In: Berichte der deutschen chemischen Gesellschaft. Jg. 1938, Bd. 71, 408. doi:10.1002/cber.19380710237
- ↑ Hellmut Bredereck, Martin Köthnig, Eva Berger: Über die d-Ribose (Darstellung einer krystallisierten Anhydroribose), In: Berichte der deutschen chemischen Gesellschaft. 1940, Bd. 73, 956. doi:10.1002/cber.19400730906
- ↑ Emil Fischer, Oscar Piloty: Ueber eine neue Pentonsäure und die zweite inactive Trioxyglutarsäure. In: Berichte der deutschen chemischen Gesellschaft. Band 24, Nr. 2, 1891, S. 4214–4225, doi:10.1002/cber.189102402322.
- ↑ W. Alberda van Ekenstein, J. Blanksma: Über krystallisierte l-Ribose. In: Chemisch Weekblad Bd. 6, S. 373–375. Nach dem Referat von Henle in Chemisches Zentralblatt Jg. 1908, Bd. 2, S. 1584.
- ↑ W. Alberda van Ekenstein, J. Blanksma: Über d-Ribose. In: Chemisch Weekblad Bd. 10, S. 664. Nach dem Referat von Schönfeld in Chemisches Zentralblatt Jg. 1913, Bd. 2, S. 1562.
- ↑ Otto Ruff: Ueber die Verwandlung der d-Gluconsäure in d-Arabinose, In: Berichte der deutschen Chemischen Gesellschaft, Jg. 1898, Bd. 31, S. 1573. doi:10.1002/cber.18980310250
- ↑ Marguerite Steiger, Helvetica chimica Acta. Bd. 19, S. 189. In ihrer digitalisierten, im Internet zugänglichen Dissertation sind experimentelle Details ausführlich beschrieben. https://www.research-collection.ethz.ch/bitstream/handle/20.500.11850/133644/1/eth-20781-01.pdf
- ↑ Paul Karrer, B. Becker, F. Benz, P. Frei, H. Salomon, K. Schopp, Zur Synthese des Lactoflavins. In: Helvetica Chimica Acta. Jg. 1935, Bd. 18, S. 1435–1448. DOI:10.1002/hlca.193501801196
- ↑ M. Helanto, K. Kiviharju, T. Granström, M. Leisola, A. Nyyssölä: Biotechnological production of l-ribose from l-arabinose. In: Applied Microbiology and Biotechnology. Jg. 2009, Bd. 83, S. 77–83.
- ↑ Wolfram Saenger: Principles of Nucleic Acid Structure. Serie: Springer Advanced Texts in Chemistry. Springer-Verlag, 1984, S. 17–21, S. 55 ff. doi:10.1007/978-1-4612-5190-3.
Auf dieser Seite verwendete Medien
Struktur von Ribose
Struktur von beta-D-Ribopyranose (Haworth-Schreibweise)
Struktur von Adenosin
Autor/Urheber: Durfo, Lizenz: CC BY-SA 4.0
Principle of a partial synthesis of L-ribose from L-arabinose according to Fischer & Piloty
Struktur von alpha-D-Ribopyranose (Haworth-Schreibweise)
SNFG Symbol für Ribose
Struktur von Adenosinmonophosphat
Struktur von D-Ribose als Keilstrichformel