Retromer
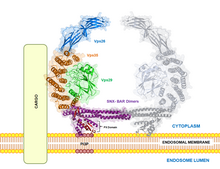
Ein Retromer ist ein Proteinkomplex, der am Transport von Membranproteinen in Vesikeln zwischen Endosomen und dem trans beteiligt ist.
Aufbau
Retromere bestehen in Säugerzellen aus fünf verschiedenen Proteinen (ein Heteropentamer), darunter ein Heterodimer aus zwei der Sorting Nexine SNX1, SNX2, SNX5 und SNX6 sowie einem Heterotrimer aus Vps26, Vps29 und Vps35 (Vacuolar protein sorting). Sie dienen gleichzeitig als membranstabilisierendes Proteingerüst und als Sortierungssignal.[1] Retromere sind am Transport innerhalb der Zelle, an der Signaltransduktion während der Entwicklung und an der Entstehung von Lysosomen beteiligt.[2] In polarisierten Zellen wie Epithelzellen und Neuronen dient das Retromer auch der Transzytose.[3] In Hefen besteht ein Retromer aus den fünf Proteinen Vps5, Vps17, Vps26, Vps29 und Vps35.[1] Die Untereinheit Vps35 bindet verschiedene zelluläre Membranproteine zur Sortierung.[4] Ein Heterodimer aus SNX1 oder SNX2 mit SNX5 oder SNX6 leiten die Ausstülpung der Endosomenmembran zu einer schlauchförmigen Membranstruktur ein, von der Transportvesikel abgeschnürt werden.[5][6] Die Abschnürung eines Vesikels aus der schlauchförmigen Ausstülpung wird neben der Aktinpolymerisation noch durch Dynamin-II oder EHD1 vermittelt.[7]
Sortierung
Die Sortierung am Retromer entscheidet über den Verbleib eines gebundenen Membranproteins im Endosom und dem späteren Abbau im Lysosom oder über den Transport vom Endosom ins trans-Golgi-Netzwerk nahe der Zellmembran.[8] Vps 35 bindet den WASH-Proteinkomplex (genauer FAM21 und WASH1).[9] Die Sortierung in verschiedene Vesikel erfordert eine Sortierung der Membranproteine in verschiedene Bereiche der Endosomenmembran,[10] an denen eine schlauchförmigen Ausstülpung der Endosomenmembran zur Bildung von Transportvesikeln stattfindet. Die zu sortierenden Membranproteine binden an den die trimere Untereinheit Vps35-Vps29-Vps26 des Retromers (der cargo-selective complex, CSC).[10]
Die Sortierung der Proteine in der Endosomenmembran erfolgt durch die Bindung des WASH-Komplexes, der auf der zytosolischen Seite der Endosomenmembran Arp2/3 aktiviert.[10] Dadurch entstehen Aktinfilamente, die eine Seitwärtsbewegung des Retromers und seiner Beladung (gebundene Membranproteine) in der Endosomenmembran vermitteln.[10] Die Bindung der trimeren Untereinheit Vps35-Vps29-Vps26 an die zu sortierenden Membranproteine erfolgt an deren zytosolischen Bereichen.[11] Daraufhin bindet GTP-aktiviertes Rab7,[12] Clathrin, Clathrin-Adapterproteine und weitere Proteine.[13]
Sortierte Proteine
Mehr als 100 Membranproteine werden vom Retromer sortiert.[14] Eine Störung des Retromers vermindert die Menge dieser Proteine in der Zellmembran deutlich.[14] Zu den sortierten Proteinen gehört M6PR (synonym CIMPR),[15] GPR177,[16] Sortilin 1,[17] DMT1-II (synonym Slc11a2),[18] Wntless (synonym MIG-14),[18] Crumbs[18] und ein noch unbekanntes Protein, das Amyloid-Precursor-Protein transportiert.[18]
Pathogene
Intrazellulär in Vesikeln lebende Bakterien haben verschiedene Mechanismen zur Hemmung des Vesikeltransports entwickelt.[19] Das Protein RidL von Legionella pneumophila hemmt das Retromer, während IncE von Chlamydia trachomatis SNX5/6 hemmt.[19]
Anwendungen
Retromere werden in Bezug auf die Entstehung von neurodegenerativen Erkrankungen wie Morbus Alzheimer und Morbus Parkinson untersucht.[20][21]
Einzelnachweise
- ↑ a b C. Trousdale, K. Kim: Retromer: Structure, function, and roles in mammalian disease. In: European journal of cell biology. Band 94, Nr. 11, November 2015, S. 513–521, doi:10.1016/j.ejcb.2015.07.002. PMID 26220253.
- ↑ J. J. Liu: Retromer-Mediated Protein Sorting and Vesicular Trafficking. In: Journal of genetics and genomics = Yi chuan xue bao. Band 43, Nr. 4, April 2016, S. 165–177, doi:10.1016/j.jgg.2016.02.006. PMID 27157806.
- ↑ M. Vergés: Retromer in Polarized Protein Transport. In: International review of cell and molecular biology. Band 323, 2016, S. 129–179, doi:10.1016/bs.ircmb.2015.12.005. PMID 26944621.
- ↑ M. N. Seaman: Cargo-selective endosomal sorting for retrieval to the Golgi requires retromer. In: The Journal of Cell Biology. Band 165, Nr. 1, April 2004, S. 111–122, doi:10.1083/jcb.200312034, PMID 15078902, PMC 2172078 (freier Volltext).
- ↑ A. Shimada, H. Niwa, K. Tsujita, S. Suetsugu, K. Nitta, K. Hanawa-Suetsugu, R. Akasaka, Y. Nishino, M. Toyama, L. Chen, Z. J. Liu, B. C. Wang, M. Yamamoto, T. Terada, A. Miyazawa, A. Tanaka, S. Sugano, M. Shirouzu, K. Nagayama, T. Takenawa, S. Yokoyama: Curved EFC/F-BAR-domain dimers are joined end to end into a filament for membrane invagination in endocytosis. In: Cell. Band 129, Nr. 4, Mai 2007, S. 761–772, doi:10.1016/j.cell.2007.03.040, PMID 17512409.
- ↑ V. K. Bhatia, K. L. Madsen, P. Y. Bolinger, A. Kunding, Hedegård P, Gether U, Stamou D: Amphipathic motifs in BAR domains are essential for membrane curvature sensing. In: The EMBO Journal. Band 28, Nr. 21, November 2009, S. 3303–3314, doi:10.1038/emboj.2009.261, PMID 19816406, PMC 2776096 (freier Volltext).
- ↑ E. Walseng, O. Bakke, P. A. Roche: Major histocompatibility complex class II-peptide complexes internalize using a clathrin- and dynamin-independent endocytosis pathway. In: The Journal of Biological Chemistry. Band 283, Nr. 21, Mai 2008, S. 14717–14727, doi:10.1074/jbc.M801070200, PMID 18378669, PMC 2386912 (freier Volltext).
- ↑ M. Gallon, P. J. Cullen: Retromer and sorting nexins in endosomal sorting. In: Biochemical Society transactions. Band 43, Nr. 1, Februar 2015, S. 33–47, doi:10.1042/BST20140290. PMID 25619244.
- ↑ M. N. Seaman, A. Gautreau, D. D. Billadeau: Retromer-mediated endosomal protein sorting: all WASHed up! In: Trends in cell biology. Band 23, Nr. 11, November 2013, S. 522–528, doi:10.1016/j.tcb.2013.04.010. PMID 23721880, PMC 3924425 (freier Volltext).
- ↑ a b c d M. N. Seaman, A. Gautreau, D. D. Billadeau: Retromer-mediated endosomal protein sorting: all WASHed up! In: Trends in cell biology. Band 23, Nr. 11, November 2013, S. 522–528, doi:10.1016/j.tcb.2013.04.010. PMID 23721880, PMC 3924425 (freier Volltext).
- ↑ S. F. Nothwehr, S. A. Ha, P. Bruinsma: Sorting of yeast membrane proteins into an endosome-to-Golgi pathway involves direct interaction of their cytosolic domains with Vps35p. In: The Journal of Cell Biology. Band 151, Nr. 2, Oktober 2000, S. 297–310, doi:10.1083/jcb.151.2.297, PMID 11038177, PMC 2192648 (freier Volltext).
- ↑ R. Rojas, T. van Vlijmen, G. A. Mardones, Y. Prabhu, A. L. Rojas, S. Mohammed, A. J. Heck, G. Raposo, P. van der Sluijs, J. S Bonifacino: Regulation of retromer recruitment to endosomes by sequential action of Rab5 and Rab7. In: The Journal of Cell Biology. Band 183, Nr. 3, November 2008, S. 513–526, doi:10.1083/jcb.200804048, PMID 18981234, PMC 2575791 (freier Volltext).
- ↑ I. J. McGough, P. J. Cullen: Recent advances in retromer biology. In: Traffic. Band 12, Nr. 8, August 2011, S. 963–971, doi:10.1111/j.1600-0854.2011.01201.x, PMID 21463457.
- ↑ a b F. Steinberg, M. Gallon, M. Winfield, E. C. Thomas, A. J. Bell, K. J. Heesom, J. M. Tavaré, P. J. Cullen: A global analysis of SNX27-retromer assembly and cargo specificity reveals a function in glucose and metal ion transport. In: Nature cell biology. Band 15, Nr. 5, Mai 2013, S. 461–471, doi:10.1038/ncb2721. PMID 23563491, PMC 4052425 (freier Volltext).
- ↑ C. N. Arighi, L. M. Hartnell, R. C. Aguilar, C. R. Haft, J. S. Bonifacino: Role of the mammalian retromer in sorting of the cation-independent mannose 6-phosphate receptor. In: The Journal of Cell Biology. Band 165, Nr. 1, April 2004, S. 123–133, doi:10.1083/jcb.200312055, PMID 15078903, PMC 2172094 (freier Volltext).
- ↑ T. Y. Belenkaya, Y. Wu, X. Tang, B. Zhou, L. Cheng, Y. V. Sharma, D. Yan, E. M. Selva, X. Lin: The retromer complex influences Wnt secretion by recycling wntless from endosomes to the trans-Golgi network. In: Developmental Cell. Band 14, Nr. 1, Januar 2008, S. 120–131, doi:10.1016/j.devcel.2007.12.003, PMID 18160348.
- ↑ M. Canuel, A. Korkidakis, K. Konnyu, C. R. Morales: Sortilin mediates the lysosomal targeting of cathepsins D and H. In: Biochemical and Biophysical Research Communications. Band 373, Nr. 2, August 2008, S. 292–297, doi:10.1016/j.bbrc.2008.06.021, PMID 18559255.
- ↑ a b c d M. N. Seaman: The retromer complex – endosomal protein recycling and beyond. In: Journal of cell science. Band 125, Nr. 20, Oktober 2012, S. 4693–4702, doi:10.1242/jcs.103440. PMID 23148298, PMC 3517092 (freier Volltext).
- ↑ a b N. Personnic, K. Bärlocher, I. Finsel, H. Hilbi: Subversion of Retrograde Trafficking by Translocated Pathogen Effectors. In: Trends in microbiology. Band 24, Nr. 6, Juni 2016, S. 450–462, doi:10.1016/j.tim.2016.02.003. PMID 26924068.
- ↑ C. Li, S. Z. Shah, D. Zhao, L. Yang: Role of the Retromer Complex in Neurodegenerative Diseases. In: Frontiers in aging neuroscience. Band 8, 2016, S. 42, doi:10.3389/fnagi.2016.00042. PMID 26973516, PMC 4772447 (freier Volltext).
- ↑ S. Wang, H. J. Bellen: The retromer complex in development and disease. In: Development. Band 142, Nr. 14, Juli 2015, S. 2392–2396, doi:10.1242/dev.123737. PMID 26199408, PMC 4510866 (freier Volltext).
Auf dieser Seite verwendete Medien
Autor/Urheber: Kianzoidlee, Lizenz: CC BY-SA 3.0
A schematic diagram showing the binding of the Retromer complex with a cargo molecule from the endosome. The Retromer complex comprises the Vps trimer (Vps35-29-26) and SNX-BAR dimers
