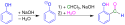Reimer-Tiemann-Reaktion
Die Reimer-Tiemann-Reaktion ist eine Namensreaktion in der Organischen Chemie. Die Schlüsselreaktion wurde von Karl Reimer entdeckt und von Ferdinand Tiemann intensiver erforscht.[1] Die Reimer-Tiemann-Reaktion stellt dabei die Reaktion von Phenolen mit Dichlorcarben dar, das aus Chloroform in alkalischer Lösung bei höherer Temperatur entsteht und sehr instabil ist. Überwiegend wird dann das ortho-Formylierungsprodukt erhalten, während andere Formylierungsreaktionen, wie die Gattermann-Synthese, überwiegend das para-Produkt liefern.[2]
Mechanismus
Zunächst muss für die Reaktion das Dichlorcarben erhalten werden. Zu diesem Zweck reagiert Chloroform 1 zunächst mit der Base über das Carbanion 2 zum Dichlorcarben (3) (Singulett-Carben). Dabei wird Chloroform deprotoniert und spaltet dann ein Chloridion ab.
Nun wird das Dichlorcarben mit Phenol zur Reaktion gebracht. Phenol 4 liegt unter den Reaktionsbedingungen als Phenolat 5 vor. Das Dichlorcarben (3) lagert sich am mesomeren Phenolat-Anion in ortho-Position unter Bildung von 6 an. Aus dem Primärprodukt 6 entsteht durch Protonenwanderung das Carbanion 7. Nach der Abspaltung eines Chloridions und einer anschließenden Rearomatisierung wird das entstandene Carbeniumion 9 hydrolysiert und das Phenolatanion 11 erhalten. Nach weiterer Chloridion-Abspaltung entsteht ein Dienon 12, das nach einer Dienon-Phenol-Umlagerung zum aromatischen Endprodukt 13 tautomerisiert.[3]
Die Ausbeute der Reaktion liegt im Allgemeinen unter 50 %, daher wird sie nur noch selten angewandt. Ihr Vorteil liegt in der ortho-Selektivität. Die Reaktion kann durch Ultraschall günstig beeinflusst werden, die Reaktionszeit verkürzt sich und die Ausbeute steigt.
Literatur
- Hans Wynberg, Egbert W. Meijer: The Reimer–Tiemann Reaction. In: Organic Reactions. Bd. 28, Nr. 1, 1982, S. 1–36, doi:10.1002/0471264180.or028.01.
- Hans Wynberg: The Reimer-Tiemann Reaction. In: Barry M. Trost, Ian Fleming: Comprehensive Organic Synthesis. Selectivity, Strategy & Efficiency in Modern Organic Chemistry. Band 2: Additions to C – X π-bonds. Teil 2. Pergamon Press, Oxford u. a. 1991, ISBN 0-08-040593-2, S. 769–775.
- Hans Wynberg: The Reimer-Tiemann Reaction. In: Chemical Reviews. Bd. 60, Nr. 2, 1960, S. 169–184, doi:10.1021/cr60204a003.
Einzelnachweise
- ↑ K. Reimer: Ueber eine neue Bildungsweise aromatischer Aldehyde. In: Berichte der Deutschen Chemischen Gesellschaft. Band 9, Nr. 1, 1876, S. 423–427, (Digitalisat).
- ↑ K. Reimer, F. Tiemann: Ueber die Einwirkung von Chloroform auf alkalische Phenolate. In: Berichte der Deutschen Chemischen Gesellschaft. Band 9, Nr. 1, 1876, S. 824–828, (Digitalisat). – K. Reimer, F. Tiemann: Ueber die Einwirkung von Chloroform auf alkalische Phenole und besonders aromatische Oxysäuren in alkalischer Lösung. In: Berichte der Deutschen Chemischen Gesellschaft. Band 9, Nr. 2, 1876, S. 1268–1278, (Digitalisat). – K. Reimer, F. Tiemann: Ueber die Einwirkung von Tetrachlorkohlenstoff auf Phenol in alkalischer Lösung (Bildung von Salicylsäure und Paroxybenzooesäure). In: Berichte der Deutschen Chemischen Gesellschaft. Band 9, Nr. 2, 1876, S. 1285–1287, (Digitalisat).
- ↑ Zerong Wang: Comprehensive Organic Name Reactions and Reagents. Band 3. Wiley, Hoboken NJ 2009, ISBN 978-0-470-53346-8, S. 2329.
Auf dieser Seite verwendete Medien
Struktur der Reimer-Tiemann-Reaktion
Struktur der Reimer-Tiemann-Reaktion
Struktur der Reimer-Tiemann-Reaktion