Radiojodtherapie
Die Radiojodtherapie (RJT, auch Radioiodtherapie, RIT) ist ein nuklearmedizinisches Therapieverfahren zur Behandlung der Schilddrüsenautonomie, des Morbus Basedow, der Schilddrüsenvergrößerung und bestimmter Formen des Schilddrüsenkrebses. Eingesetzt wird das radioaktive Jod-Isotop Jod-131, das ein überwiegender Beta-Strahler mit einer Halbwertszeit von acht Tagen ist und im menschlichen Körper nur in Schilddrüsenzellen gespeichert wird.
Die Radiojodtherapie unterliegt in vielen Ländern besonderen gesetzlichen Voraussetzungen und kann in Deutschland nur stationär durchgeführt werden. Die Therapieform wird seit den 1940er Jahren angewendet und gilt als nebenwirkungsarm und auch in der langjährigen Verlaufsbeobachtung als sicher. In Deutschland existieren (Stand 2014) etwa 120 Therapieeinrichtungen, in denen etwa 50.000 Behandlungen jährlich durchgeführt werden.[1]
Anwendungsgebiete und Alternativen
Die häufigsten Indikationen der Radiojodtherapie sind die autonomen Funktionsstörungen der Schilddrüse (autonomes Adenom, multifokale Autonomie, disseminierte Autonomie), die Basedow-Krankheit (Morbus Basedow) und diejenigen Formen des Schilddrüsenkrebses (Schilddrüsen-Karzinom), die Jod speichern: das papilläre und das follikuläre Schilddrüsenkarzinom. Auch eine Schilddrüsenvergrößerung (Struma) ohne Funktionsstörung wird zunehmend mittels Radiojodtherapie behandelt.[2]
Schwangerschaft gilt als absolute Kontraindikation für die Radiojodtherapie bei gutartigen Schilddrüsenerkrankungen. Aus allgemeinen strahlenbiologischen Erwägungen wird empfohlen, bis zu 6 Monate nach der Radiojodtherapie eine Schwangerschaft zu vermeiden. Tritt in dieser Zeit doch eine Schwangerschaft ein, so ist dies kein ausreichender Grund für einen Schwangerschaftsabbruch. Es wird jedoch empfohlen, eine genetische Beratung in Anspruch zu nehmen. Für die Radiojodtherapie beim Schilddrüsenkrebs in der Schwangerschaft gilt, dass zwar die theoretische Wahrscheinlichkeit für das Auftreten einer genetischen Schädigung berechenbar ist, solche Schäden in der Realität aber bisher nicht aufgetreten sind.[2]
Alternative Behandlungsverfahren für die Funktionsstörungen sind verschiedene Formen der Schilddrüsenoperation und bei autonomen Adenomen in bestimmten Fällen die Verödung mit Alkohol.[3] Der Morbus Basedow kann in einem Teil der Fälle unter der medikamentösen Behandlung mit Thyreostatika vorübergehend oder dauerhaft in seiner Aktivität nachlassen (Remission), als endgültige („definitive“) Therapie kommt neben der Radiojodtherapie auch die Operation in Frage. Bei den Schilddrüsen-Karzinomen kann nur beim papillären Karzinom im Frühstadium pT1a nach der Operation auf die Radiojodtherapie verzichtet werden. Zur Behandlung der gutartigen Schilddrüsenvergrößerung werden medikamentöse Therapie, Operation und Radiojodtherapie eingesetzt.
Bei der Wahl zwischen Operation und Radiojodtherapie sprechen folgende Argumente für die nichtoperative Methode: Wenn die Schilddrüse früher bereits operiert wurde oder bereits eine (einseitige) Lähmung des Stimmbandnervs (Rekurrensparese) vorliegt, bei Patienten in höherem Lebensalter oder mit schweren Begleiterkrankungen, wenn die Schilddrüse relativ klein ist oder der Patient unter Operationsangst leidet. Jugendliches Alter gilt nicht mehr als Kontraindikation. Folgende Argumente sprechen hingegen für die Operation: Verdacht auf Bösartigkeit (Malignität), durch Jod verursachte Schilddrüsenüberfunktion (Hyperthyreose), Schwangerschaft und Stillzeit, floride Augenbeteiligung bei Morbus Basedow (endokrine Orbitopathie), Zeichen einer Einengung (Kompression) der Nachbarstrukturen (Luftröhre: Stridor, Speiseröhre: ausgeprägte Schluckstörung, Halsgefäße: obere Einflussstauung), Strahlenangst oder größere kalte Gebiete der Schilddrüse.[2][4]
Veterinärmedizin
In der Tiermedizin gilt die Radiojodtherapie bei der Schilddrüsenüberfunktion der Katzen als Therapiemethode der Wahl, wird aber wegen der erforderlichen technischen Voraussetzungen und der Strahlenschutz-Anforderungen nur in geringem Ausmaß durchgeführt.[5]
Gesetzliche Voraussetzungen
In den meisten Ländern unterliegt die Durchführung der Radiojodtherapie bestimmten gesetzlichen und quasi-gesetzlichen Regelungen. In vielen Ländern kann die Radiojodtherapie ambulant (das heißt ohne stationären Krankenhausaufenthalt) durchgeführt werden.
In Deutschland regeln die Strahlenschutzverordnung und die vom Länderausschuss für Atomkernenergie herausgegebene Richtlinie „Strahlenschutz in der Medizin“ die Durchführung der Radiojodtherapie. Sie legen fest, dass die Therapie nur auf einer nuklearmedizinischen Therapiestation durchgeführt werden darf. Der durchführende Arzt muss eine entsprechende Umgangsgenehmigung haben, deren Erteilung unter anderem an die „Fach- und Sachkunde auf dem Gebiet der Anwendung radioaktiver Stoffe in der Diagnostik und Therapie“ geknüpft ist. Die Anwesenheit eines Medizinphysikexperten ist notwendig. Den Erfordernissen des Strahlenschutzes ist in Bezug auf bauliche und personelle Aspekte Rechnung zu tragen. Insbesondere muss eine geeignete Abklinganlage für radioaktiv kontaminierte Abwässer vorhanden sein. Das betreuende Personal muss regelmäßig im Strahlenschutz unterwiesen werden.
Ambulante Therapien sind in Österreich möglich. Die Grenzaktivitäten sind gesetzlich festgelegt. Auch in Österreich ist die Anwesenheit eines Medizinphysikers vorgeschrieben.
In der Schweiz dürfen Radiojodtherapien mit einer applizierten Aktivität bis 200 MBq ambulant durchgeführt werden.
In den USA dürfen Radiojodtherapien bis zu einer Aktivität von 1110 MBq ambulant durchgeführt werden. Die Mehrzahl der Therapien bei gutartigen Schilddrüsenerkrankungen kann damit ambulant vorgenommen werden.
Therapieprinzip und physikalische Grundlagen

Das verwendete radioaktive Jod-Isotop Jod-131 steht als Natriumjodid in Kapselform und in wässriger Lösung zur Verfügung. Es wird in der Regel peroral verabreicht, kann in Ausnahmefällen (zum Beispiel bei ausgeprägten Schluckstörungen) auch intravenös appliziert werden. Bei peroraler Aufnahme wird das Jod rasch über die Magenschleimhaut aufgenommen und an das Blut abgegeben (Resorption). Über den Natrium-Jodid-Symporter gelangt das Jod in die Schilddrüsenzelle und wird letztlich im Schilddrüsenfollikel gespeichert. Unter der Wirkung von TSH oder TSH-Rezeptor-Autoantikörpern ist die Aufnahme von Jod in die Schilddrüsenzellen erhöht. Autonome Anteile der Schilddrüse nehmen Jod unabhängig vom TSH auf.
Die besondere Eleganz der Radiojodtherapie liegt darin, dass nur Schilddrüsenzellen Jod – und damit auch Radiojod – aufnehmen, andere Organe speichern kein Jod. Das nicht in der Schilddrüse gespeicherte Jod wird innerhalb kurzer Zeit über die Nieren und damit über den Urin aus dem Körper eliminiert. Geringe Mengen werden von den Schweißdrüsen und über den Darm ausgeschieden. In geringem Maße wird Jod zwar von den Speicheldrüsen und der Magenschleimhaut ausgeschieden, über den Magen-Darm-Trakt aber wieder aufgenommen. Wegen dieser besonderen Eigenschaften des Jod-Stoffwechsels ist es möglich, eine sehr große Strahlendosis im Zielgewebe (Herddosis) zu erreichen, während die übrigen Gewebe nur eine geringe Strahlenexposition haben.
Jod-131 ist ein in Kernreaktoren hergestelltes Nuklid und hat eine Halbwertszeit von 8,02 Tagen. Bei seinem Zerfall zu stabilem Xenon wird ein Beta-Teilchen frei – mit der maximalen Energie von 0,61 MeV und einer mittleren Reichweite in Gewebe von 0,5 mm. Diese Strahlung ist für die therapeutische Wirkung verantwortlich. Darüber hinaus wird auch Gammastrahlung mit dem Hauptpeak bei 364 keV frei, die die Schilddrüse verlassen kann und daher einerseits für die unerwünschte Strahlenexposition des Patienten und der Umgebung verantwortlich ist, andererseits aber auch für die Bildgebung und den Radiojodtest verwendet werden kann.
Die Betastrahlen bewirken in der Umgebung der Schilddrüsenzellen Schäden in der DNA, insbesondere Doppelstrangbrüche, die letztlich zur Einleitung des programmierten Zelltods (Apoptose) führen (→ Wirkungsmechanismus der Strahlentherapie).
Die Radiojodtherapie bei gutartigen Schilddrüsenerkrankungen
Vorbereitung
Jodkarenz

Um eine optimale Aufnahme des Jods in die Schilddrüse zu erreichen, sollen vor dem Radiojodtest und der Therapie mit radioaktivem Jod zusätzliche Jodquellen gemieden werden (Jodkarenz). Solche Jodquellen sind insbesondere jodhaltige Kontrastmittel, das Antiarrhythmikum Amiodaron und bestimmte jodhaltige Desinfektionsmittel. Bei wasserlöslichen Kontrastmitteln reicht eine Karenzzeit von 6 Wochen. Nach der Anwendung fettlöslicher Kontrastmitteln oder des ebenfalls fettlöslichen Amiodaron kann die Schilddrüse für viele Monate blockiert sein.
Jod in nennenswerten Mengen ist in vielen Multivitaminpräparaten und Nahrungsergänzungsmitteln enthalten, sowie in Seefisch, Meeresfrüchten und bestimmten Produkten aus Algen. Diese Jodquellen sollen für etwa eine Woche vor Jodtest und Therapie vermieden werden. Die Einnahme von Jod aus jodiertem Speisesalz und von mit diesem zubereiteten, industriell gefertigten Lebensmitteln ist praktisch nicht vollständig zu vermeiden.
Stoffwechseleinstellung

Die Radiojodtherapie soll möglichst nicht bei manifest hyperthyreoter Stoffwechsellage durchgeführt werden, da die Überfunktion durch Freisetzung der Schilddrüsenhormone Thyroxin (T4) und Trijodthyronin (T3) verstärkt werden kann. Daher sollen mit der niedrigsten möglichen Dosis von Thyreostatika in den Wochen vor der Radiojodtherapie normale Werte für T4 und T3 eingestellt werden. Allerdings vermindern Thyreostatika die Jodaufnahme in die Schilddrüse, so dass empfohlen wird, diese wenigstens ein bis zwei Tage vor der Radiojodtherapie abzusetzen.
Bei der Schilddrüsenautonomie sollte der TSH-Wert zum Zeitpunkt der Radiojodtherapie möglichst supprimiert sein, um über den thyreotropen Regelkreis die Jodaufnahme in nicht-autonome Anteile der Schilddrüse zu minimieren. Gegebenenfalls müssen hierfür in der Vorbereitungsphase Schilddrüsenhormone gegeben werden. Bei der euthyreoten Struma wird die Therapie in der Regel ohne begleitende Schilddrüsen-gerichtete Medikamente durchgeführt.
Ermittlung der geeigneten Therapie-Aktivität
Die deutsche Richtlinie „Strahlenschutz in der Medizin“ schreibt vor: „Bei der Planung einer nuklearmedizinischen Behandlung ist die Dosis für die zu behandelnden Organe oder Gewebe […] im voraus zu ermitteln und die danach zu verabreichende Aktivität zu bemessen. Soweit patientenspezifische Parameter benötigt werden, sind hierfür individuelle Messungen und Daten heranzuziehen.“[6]
Bei der Ermittlung der zur Therapie notwendigen Aktivität ist in Deutschland und in Österreich neben dem Nuklearmediziner auch ein Medizinphysiker hinzuzuziehen. In die Berechnung gehen die Zieldosis, das Zielvolumen und das Integral der Aktivität in der Schilddrüse über die Zeit ein.
Das Zielvolumen der Radiojodtherapie und die im Zielvolumen angestrebte Energiedosis richten sich nach der zu behandelnden Erkrankung. Beim Morbus Basedow, bei der Schilddrüsenvergrößerung ohne Autonomie und bei der disseminierten Autonomie wird das sonografisch bestimmte Gesamtvolumen der Schilddrüse als Zielvolumen angenommen, bei der unifokalen und multifokalen Autonomie nur das Volumen der Adenome. Die angestrebten Zieldosen laut Leitlinie der Deutschen Gesellschaft für Nuklearmedizin zur Radiojodtherapie bei benignen Schilddrüsenerkrankungen sind in folgender Tabelle angegeben.
| Angestrebte Zieldosis bei der Radiojodtherapie[4] | effektive Halbwertszeit[2] | ||
|---|---|---|---|
| Erkrankung | angestrebte Zieldosis | Euthyreose | Hyperthyreose |
| Unifokale Autonomie | etwa 300 bis 400 Gy | 4,8 Tage | 4,2 Tage |
| Multifokale Autonomie | etwa 150 Gy | 5,5 Tage | 4,8 Tage |
| Disseminierte Autonomie | etwa 150 Gy | 5,5 Tage | 4,8 Tage |
| Morbus Basedow | — | — | 4,2 Tage |
| Ablatives Konzept | etwa 200 bis 300 Gy | — | — |
| Funktionsoptimiertes Konzept | etwa 150 Gy | — | — |
| Struma zur Verkleinerung | etwa 120 bis 150 Gy | 5,5 Tage | — |
Das Aktivitäts-Zeit-Integral kann mit dem Radiojodtest ermittelt werden. Hierzu wird eine geringe Menge Radiojod verabreicht (meist peroral): etwa 1 bis 5 MBq Jod-131 oder – seltener – 5 bis 10 MBq Jod-123.[2] Zu bestimmten Zeitpunkten wird die Aktivität über der Schilddrüse gemessen und ins Verhältnis zur Ausgangsaktivität und ihrem natürlichen Zerfall gesetzt. Zu bestimmen sind die maximale Aufnahme (uptake) in Prozent und die effektive Halbwertszeit in Tagen. Je mehr Messpunkte vorliegen, desto genauer kann die Fläche unter der Kurve bestimmt werden. Aus Gründen der praktischen (ambulanten) Durchführbarkeit wird meist nur nach 24 und 48 Stunden gemessen, unter Umständen auch nur nach 24 Stunden. Beim Morbus Basedow wird wegen des beschleunigten Jodumsatzes eine erste Messung bereits nach vier bis acht Stunden gefordert. Zur genauen Bestimmung der effektiven Halbwertszeit wird eine weitere Messung nach vier bis acht Tagen notwendig. Wegen nur geringer Unterschiede der effektiven Halbwertszeit zwischen den einzelnen Patienten mit gleicher Erkrankung und gleicher Stoffwechsellage kann die effektive Halbwertszeit auch als empirisch ermittelter Wert angenommen werden (siehe Tabelle).
Die anzuwendende Therapie-Aktivität kann dann nach der Marinelli-Formel (nach Leonidas D. Marinelli, 1906–1974, Argonne National Laboratory) berechnet werden.[7][8]
Hierbei ist A die zu errechnende Aktivität in Megabecquerel, HD die angestrebte Herddosis in Gray, V das bestimmte Zielvolumen in Milliliter, K eine empirisch ermittelte Konstante von 24,7 (dimensionslos), Umax der maximale uptake in Prozent und t0,5 eff die effektive Halbwertszeit in Tagen.
Cortison-Vorbehandlung bei endokriner Orbitopathie
Eine endokrine Orbitopathie (eO) bei Morbus Basedow kann sich unter der Radiojodtherapie verschlechtern oder erstmals auftreten. Bei vorbestehender eO wird daher ab dem Tag der Radiojodtherapie oder dem Tag zuvor eine Behandlung mit Glucocorticoiden (Cortison) empfohlen, die Dosierung richtet sich nach dem Schweregrad der Augenerkrankung. Beim Morbus Basedow ohne endokrine Orbitopathie ist die prophylaktische Gabe von Glucocorticoiden umstritten. Die möglichen Nebenwirkungen und Kontraindikationen der Cortison-Therapie (Diabetes mellitus, Magengeschwüre und Elektrolytstörungen) sind zu beachten.[2]
Aufklärung
Vor Beginn von Radiojodtest und Radiojodtherapie erfolgt eine Aufklärung. In dieser wird der Patient auf den Ablauf von Test und Therapie sowie Risiken und Nebenwirkungen der Radiojodtherapie hingewiesen. In den Ländern, in denen die Radiojodtherapie nur stationär durchgeführt werden kann, ist insbesondere Gegenstand des Aufklärungsgespräches, dass nach Gabe der Therapieaktivität der Patient die Therapiestation nicht verlassen darf. Der Patient wird außerdem darauf hingewiesen, dass regelmäßige Nachuntersuchungen medizinisch geboten und gesetzlich vorgeschrieben sind (siehe Abschnitt Nachsorge).
Durchführung
Nach der meist peroralen – in Ausnahmefällen intravenösen – Gabe des Jod-131 muss in Deutschland der Patient mindestens 48 Stunden auf der Therapiestation verbleiben. Es wird empfohlen, etwa eine Stunde nach peroraler Einnahme nüchtern zu bleiben, bis das Radiojod weitgehend resorbiert ist.[2]
Üblicherweise erfolgen dann regelmäßige Messungen der Strahlung, diese lassen Rückschlüsse auf die im gesamten Körper des Patienten beziehungsweise in der Schilddrüse verbliebene Aktivität zu. Erstere ist wichtig für den Zeitpunkt der Entlassung nach der Therapie, letztere für den Maximalwert und den zeitlichen Verlauf zur Kontrolle des Therapieerfolges. Es lassen sich nämlich der tatsächlich erreichte maximale Uptake (Umax) und die tatsächlich erzielte effektive Halbwertszeit (t0,5 eff) ermitteln und durch Umstellung der Marinelli-Formel (siehe oben) die tatsächlich erzielte Herddosis (HD) bestimmen. Das Zielvolumen V und die empirisch ermittelte Konstante K sind unverändert.
Sollte die Herddosis vom geplanten Wert wesentlich nach oben abweichen, so ist mit höherer Wahrscheinlichkeit mit der Entwicklung einer Schilddrüsen-Unterfunktion nach der Therapie zu rechnen und die Nachsorge entsprechend zu planen.
Sollte die Herddosis dagegen wesentlich nach unten abweichen, kann noch während des stationären Therapie-Aufenthaltes eine zusätzliche Gabe von Radiojod erfolgen, um die erwünschte Zieldosis noch zu erreichen und den Therapieerfolg zu sichern. Dabei ist zu beachten, dass aufgrund der Frühwirkung der Radiojodtherapie („stunning“) der Uptake der zweiten Dosis regelmäßig niedriger liegt als der der ersten.
Durch die Gabe geringer Mengen nicht-radioaktiven Jods oder von Lithium nach der Gabe des Radiojods lässt sich das Verbleiben des Radiojods in der Schilddrüse und damit die effektive Halbwertszeit t0,5 eff verlängern und eine um bis zu 30 % höhere Herddosis erzielen. Hierbei sind insbesondere beim Lithium Risiken und Nebenwirkungen sowie die geringe therapeutische Breite zu beachten.[2]
Risiken und Nebenwirkungen
Strahlenexposition
Aufgrund der biologischen Eigenschaften von Jod und der physikalischen Eigenschaften von Jod-131 verursacht die Radiojodtherapie nur eine geringe Strahlenexposition der Organe, die kein Radiojod aufnehmen. Die Strahlenexposition ist in den der Schilddrüse benachbarten Strukturen wie dem Kehlkopf oder den Nebenschilddrüsen gering – bedingt durch die geringe Reichweite der Betastrahlung aus der Schilddrüse. Einige Gewebe, die den Natrium-Jodid-Symporter exprimieren, darunter die Speicheldrüsen, Magen und die weibliche Brust, reichern vorübergehend Jod an. Nieren, Harnblase und Darm sind an der Ausscheidung des Anteils Radiojod, der nicht in der Schilddrüse gespeichert wird, beteiligt. In allen diesen Geweben liegt ein geringes Aktivitäts-Zeit-Integral vor, die Strahlenexposition ist entsprechend gering. Sie wird bei einem Uptake des Radiojods in die Schilddrüse von 25 % für die Magenwand mit 0,46 mGy/MBq angegeben, für die Ovarien mit 0,04 mGy/MBq, das rote Knochenmark 0,07 mGy/MBq, die Leber 0,035 mGy/MBq und die Hoden mit 0,028 mGy/MBq.[9] Im Zielgewebe Schilddrüse liegt dagegen die (erwünschte) Strahlendosis um vier bis fünf Zehnerpotenzen höher: bei einem Uptake von 25 % bei 350 mGy/MBq.[9]
Die Kohortenstudien von Hall 1992 mit über 45.000 Patienten[10] und Ron 1998 mit über 35.000 Patienten[11] haben keine erhöhte Krebsmortalität der mit radioaktivem Jod behandelten Patienten festgestellt. Die American Thyroid Association (amerikanische Schilddrüsengesellschaft) weist auf eine mögliche, minimal erhöhte Inzidenz von Schilddrüsen-Karzinomen nach einer Behandlung hin.[12]
Akute Nebenwirkungen
Nur in wenigen Fällen kommt es zu akuten Nebenwirkungen, diese sind meist harmlos. Am häufigsten ist die Radiothyreoiditis, eine schmerzhafte Entzündungsreaktion der Schilddrüse bedingt durch die akute Strahlenwirkung, die etwa drei bis fünf Tage nach Einnahme des Radiojods auftreten kann. Durch Kühlung und entzündungshemmende Medikamente wie nichtsteroidale Antirheumatika oder Glucocorticoide lassen sich die Beschwerden, die innerhalb weniger Tage abklingen, meistens gut lindern. Eine die Entzündung der Schilddrüse begleitende Schwellung kann lediglich bei vorbestehender Verengung der Luftröhre (Trachealstenose) zu ernsthaften Problemen wie Atemnot führen, so dass in diesen Fällen eine vorbeugende entzündungshemmende Behandlung empfohlen wird.[2]
Entzündliche Schwellungen der Speicheldrüsen kommen meist nur bei höheren Therapie-Aktivitäten vor.
Bei vorbestehender Schilddrüsenüberfunktion kann sich diese etwa sieben bis zehn Tage nach Beginn der Behandlung verschlechtern, bedingt durch den beginnenden Zellzerfall und die damit verbundene Freisetzung von Hormonen, die in der Schilddrüse gespeichert waren. Diese Komplikation kann durch eine gute Einstellung einer normalen Stoffwechsellage vor der Behandlung vermieden werden.
Eine seltene Nebenwirkung nach einer Radiojodtherapie wegen einer Schilddrüsenautonomie (zum Beispiel Autonomes Adenom) ist das zusätzliche Auftreten einer immunogenen Hyperthyreose wenige Wochen später. Dieses Phänomen wird Marine-Lenhart-Syndrom genannt und limitiert sich meistens selbst. Die Häufigkeit wird mit 0,5 bis 1 % angegeben.[2] In einem Teil der Fälle muss aber wegen der neu aufgetretenen Schilddrüsenüberfunktion eine zweite Radiojodtherapie durchgeführt werden.
Entlassung nach der Therapie
In Deutschland beträgt die Mindest-Aufenthaltsdauer auf der Therapiestation 48 Stunden. Die Entlassung hängt von der im Körper verbliebenen Restaktivität ab. 1999 wurde der Grenzwert für die Restaktivität erhöht: die Dosisleistung darf in 2 Meter Abstand vom Patienten 3,5 µSv pro Stunde nicht überschreiten, wodurch innerhalb eines Jahres bei einem Abstand von 2 Metern eine Strahlenexposition von 1 mSv nicht überschritten wird. Dies entspricht einer Restaktivität von etwa 250 MBq. Ähnliche Regelungen gelten für Österreich.
In der Schweiz darf für „andere Personen“ eine Strahlenexposition von maximal 1 mSv pro Jahr und für die Angehörigen des Patienten („nicht beruflich pflegende Personen“) maximal 5 mSv pro Jahr nicht überschritten werden.[13] Bei Entlassung nach Radiojodtherapie ist daher eine Dosisleistung in 1 Meter Abstand von höchstens 5 µSv pro Stunde zulässig, was einer Restaktivität von etwa 150 MBq entspricht.[14]
In Deutschland beträgt die mittlere Verweildauer noch etwa drei bis fünf Tage und hängt im Wesentlichen vom Zielvolumen ab. Bei sehr großen Strumen kann die Aufenthaltsdauer auch zehn Tage erreichen.[2]
Bei Entlassung wird der Patient auf eventuell noch zu beachtende Strahlenschutzmaßnahmen hingewiesen. Diese betreffen insbesondere den Umgang mit kleinen Kindern und Schwangeren. Auf mögliche Probleme mit Radioaktivitätsmessungen – an Flughäfen, Kernkraftwerken, Abfallbeseitigung – ist der Patient hinzuweisen, gegebenenfalls wird dem Patienten eine entsprechende Bescheinigung mitgegeben.
In besonderen Fällen – zum Beispiel eine akute Erkrankung des Patienten, die eine Untersuchung und Behandlung des Patienten außerhalb der Therapiestation notwendig machen – ist in Deutschland eine vorzeitige Entlassung möglich. Diese muss bis zu einer Dosisleistung von 17,5 µSv/h der Aufsichtsbehörde angezeigt werden, ab 17,5 µSv/h muss eine Genehmigung eingeholt werden. Bei Verlegung des Patienten auf eine andere Station muss der zuständige Strahlenschutzbeauftragte dafür sorgen, dass dort geeignete Maßnahmen zum Strahlenschutz ergriffen werden, zum Beispiel vorübergehend ein Kontrollbereich eingerichtet wird.
Nachsorge und Erfolge
In Deutschland ist der Arzt, der die Radiojodtherapie durchgeführt hat, auch für die Nachbetreuung verantwortlich. Es hat der für die Durchführung der Behandlung verantwortliche, fachkundige Arzt die Wirkung und die Nebenwirkungen der nuklearmedizinischen Behandlung durch geeignete, in angemessenen Zeitabständen erfolgende, Nachuntersuchungen zu erfassen und zu dokumentieren; ggf. hat er eine Behandlung einzuleiten. Der Nuklearmediziner kann Teile der Nachsorge an einen fachlich geeigneten Arzt übergeben, der diesem die Ergebnisse der Nachsorge mitzuteilen hat. Das enthebt den Nuklearmediziner aber nicht von seiner Verantwortung für die Nachsorge.[6]
Je nach behandelter Erkrankung der Schilddrüse und Stoffwechsellage beziehungsweise medikamentöser Vorbehandlung werden die ersten Kontrollen der Schilddrüsen-Laborwerte nach vier bis sechs Wochen durchgeführt, beim Morbus Basedow gegebenenfalls auch eher, um die Entwicklung einer Schilddrüsenunterfunktion rechtzeitig zu erkennen. Insbesondere bei vorbestehender endokriner Orbitopathie kann eine Unterfunktion ungünstige Auswirkungen haben und muss daher frühzeitig behandelt werden.
In den meisten Fällen tritt die vollständige Wirkung der Radiojodtherapie in den ersten drei bis sechs Monaten ein, so dass nach diesem Zeitraum eine abschließende Untersuchung zur Beurteilung des Therapieeffektes und -erfolges ansteht. Diese umfasst üblicherweise neben der Bestimmung der Schilddrüsenhormone auch ein Schilddrüsen-Sonogramm und ein -Szintigramm. Da in einem Teil der Fälle auch nach sechs Monaten noch eine gewisse Spätwirkung der Radiojodtherapie zu erwarten ist, soll die Indikation zu einer Wiederholung der Behandlung nicht zu früh gestellt werden.
Für die verschiedenen Indikationen zur Radiojodtherapie gelten unterschiedliche Therapieziele und Erfolgsquoten. Für die Autonomie der Schilddrüse ist das Ziel die Ausschaltung der autonomen Anteile der Schilddrüse. Es wird bei einer angestrebten Herddosis von 300 bis 400 Gy eine Erfolgsquote von über 90 % angegeben. Etwa 10 % der Patienten müssen wegen einer Schilddrüsenunterfunktion nach der Therapie dauerhaft mit Schilddrüsenhormonen behandelt werden („Substitution“). Bei der fokalen Autonomie kann mit einer Abnahme des Volumens der autonomen Gebiete um etwa 80 % gerechnet werden. Die Abnahme des Volumens der Gesamtschilddrüse liegt bei 20 bis 50 %.[2]
Beim Morbus Basedow ist das Ziel die dauerhafte Beseitigung der Überfunktion. Beim ablativen Therapiekonzept mit angestrebter Herddosis von 200 bis 300 Gray liegt die Erfolgsquote bei über 90 %. Allerdings sind anschließend 80 bis 90 % der Patienten dauerhaft von einer Substitution mit Schilddrüsenhormonen abhängig. Beim sogenannten funktionsoptimierten Konzept mit einer angestrebten Herddosis von etwa 150 Gray liegt die Rate an behandlungsbedürftigen Unterfunktionen zwar nur bei 40 %, allerdings die Erfolgsquote auch nur bei etwa 70 %. Insbesondere bei schwierigen Verläufen mit medikamentös nur schwer einstellbarer Überfunktion, Augenbeteiligung (endokrine Orbitopathie) oder wiederholten Rückfällen ist diese niedrige Erfolgsquote nicht akzeptabel, so dass inzwischen überwiegend das ablative Therapiekonzept angewendet wird. Für das alternative Behandlungsverfahren zur Radiojodtherapie, die Strumaresektion, ist ebenfalls regelhaft mit einer behandlungsbedürftigen Unterfunktion zu rechnen.[2]
Das Therapieziel bei der Struma ohne Überfunktion ist vor allem eine Verminderung der Schilddrüsengröße und die Beseitigung eventuell durch die Größe der Struma verursachter Beschwerden. Bei einem Ausgangsvolumen von 50 bis 100 ml ist mit einer Größenreduktion um etwa die Hälfte zu rechnen, bei sehr großer Struma mit einem Volumen von über 250 ml nur mit einer Reduktion um etwa 30 bis 40 %. In insgesamt über 80 % der Fälle wird eine Besserung der Beschwerden erreicht.[2]
Die Radiojodtherapie bei bösartigen Schilddrüsenerkrankungen

Grundlagen
Die epithelialen Karzinome der Schilddrüse, nämlich die häufigsten Untertypen papilläres Karzinom (etwa 70 %) und follikuläres Karzinom (etwa 20 %), und ihre Absiedlungen (Metastasen) haben noch ausgeprägte Ähnlichkeiten mit ihrem Ursprungsgewebe. Zum einen exprimieren sie den Natrium-Jodid-Symporter und haben daher die Fähigkeit zur Jodspeicherung, zum anderen produzieren sie Thyreoglobulin, das daher als Tumormarker dienen kann. Schilddrüsenkarzinome werden nicht selten als kalte Knoten in einer Schilddrüsenszintigraphie auffällig, das heißt die Neigung zur Jodspeicherung ist geringer ausgeprägt als bei umgebendem gesundem Schilddrüsengewebe. Unter der Stimulation mit hohen Spiegeln von TSH besteht aber auch bei bösartigen (malignen) Schilddrüsenzellen eine Aufnahme von Jod.
Anwendung
Zu unterscheiden sind die Radiojodtherapie zur Entfernung (Ablation) eventuell vorhandener Reste gesunden Schilddrüsengewebes im Sinne einer unterstützenden und die Nachsorge vereinfachenden (adjuvanten) Therapie von der Behandlung eventuell vorhandener Tumorreste oder -absiedlungen (Metastasen) unter einem Anspruch auf Heilung (kurative Therapie) oder zumindest auf Lebensverlängerung und Linderung der Beschwerden (palliative Therapie).
Eine Indikation zur ablativen Radiojodtherapie besteht bei fast allen Fällen der epithelialen Schilddrüsenkarzinome. Lediglich beim papillären Mikrokarzinom (Größe kleiner als 1 cm, pT1 N0 M0) kann unter Umständen auf eine ablative Radiojodtherapie verzichtet werden.[15]
Keine Indikation zur Radiojodtherapie besteht meist beim medullären und beim anaplastischen Schilddrüsenkarzinom, da diese Tumoren in der Regel kein Jod speichern. Schwangerschaft und Stillzeit gelten als absolute Kontraindikation.[15]
Vorbereitung
Operation
Vor der Radiojodtherapie beim epithelialen Schilddrüsenkarzinom steht grundsätzlich die Schilddrüsenoperation, meist als Thyreoidektomie durchgeführt. Ein kleiner Rest von gutartigem Schilddrüsengewebe verbleibt dabei fast immer. Bei operationstechnisch schwierigen Verhältnissen – zum Beispiel bei sehr großer Struma oder voroperierten Patienten – kann dieser Rest auch größer ausfallen, was für die weitere Behandlung der Patienten und ihre Überlebensaussichten (Prognose) aber keinen Nachteil bedeutet. Daher wird nicht empfohlen, eine absolut vollständige Entfernung der Schilddrüse anzustreben, um eine Schädigung des hinter der Schilddrüse verlaufenden Nervus laryngeus recurrens zu vermeiden.[2]
Wenn Tumorreste verblieben sind, bereits Absiedlungen (Metastasen) bestehen oder ein lokaler Rückfall (Rezidiv) vorliegt, soll zunächst operativ versucht werden, die Menge an bösartigem Gewebe so weit wie möglich zu reduzieren.
Jodkarenz
Mehr noch als bei der Radiojodtherapie gutartiger Schilddrüsenerkrankungen (siehe oben) muss in der Phase vor der Radiojodtherapie des Schilddrüsenkarzinoms darauf geachtet werden, dem Patienten kein zusätzliches Jod zukommen zu lassen.
Stimulation des Schilddrüsengewebes und Jodtest
Vor der ablativen Radiojodtherapie soll ein (verkürzter) Radiojodtest (siehe oben) von 24 Stunden Dauer durchgeführt werden. Bei einer hohen Aufnahme (Uptake) wird zur Vermeidung lokaler Komplikationen die Therapie mit verminderter Aktivität durchgeführt – und die Möglichkeit in Kauf genommen, dass später eine weitere Behandlung zur Ablation etwaiger Reste notwendig wird. Bei sehr hohem Uptake ist eine Zweitoperation zur Verminderung des Schilddrüsengewebes zu erwägen.
Um für die ablative Therapie den Uptake des Radiojods in den Schilddrüsenrest zu erhöhen, beziehungsweise für die kurative oder palliative Therapie überhaupt eine nennenswerte Aufnahme zu erreichen, müssen die verbliebenen Schilddrüsenzellen mit einem hohen Spiegel an TSH angeregt (stimuliert) werden. Der TSH-Wert soll über 30 mU/l liegen,[15] normal sind (je nach Labor) etwa 0,4 bis 4 mU/l. Dieser hohe Wert wird üblicherweise dadurch erreicht, dass der Patient zunächst nach der Operation nicht mit Schilddrüsenhormonen behandelt wird (Substitution), wie es sonst nach einer vollständigen (Thyreoidektomie) oder weitgehenden Schilddrüsenentfernung (subtotale Strumaresektion) bei gutartigen Schilddrüsenerkrankungen üblich ist. Etwa drei bis vier Wochen nach der Operation befindet sich der Patient dann in einer tiefen Schilddrüsenunterfunktion (Hypothyreose). Häufig besteht durch die Unterfunktion Arbeitsunfähigkeit und die Patienten sind darauf hinzuweisen, dass sie in dieser Phase wegen der verminderten Reaktionsfähigkeit kein Kraftfahrzeug führen und keine gefährlichen Maschinen steuern dürfen.
Als Alternative zur Unterfunktion steht seit einigen Jahren gentechnisch hergestelltes, rekombinantes, humanes TSH (rhTSH) zur Verfügung, das intramuskulär gegeben werden kann und mit dem sich durch Injektionen an zwei aufeinander folgenden Tagen TSH-Spiegel am dritten und vierten Tag von meist deutlich über 30 mU/l erreichen lassen.
Als mögliche Vorteile der Anwendung von rhTSH gegenüber der Hypothyreose können gelten: besseres Allgemeinbefinden; erhaltene Arbeitsfähigkeit; Fehlen eines anhaltenden Wachstumsreizes auf eventuell noch vorhandene Krebszellen durch mehrwöchig erhöhtes TSH; niedrigere Konzentration des Jod-131 im Serum aufgrund normaler Nierenfunktion – in Hypothyreose ist die Nierenfunktion regelhaft vorübergehend eingeschränkt – und damit geringere Strahlenexposition. Die Erfolgsraten der ablativen Radiojodtherapie sind in Unterfunktion und mit rhTSH gleich hoch.[15]
Als mögliche Nachteile sind zu erwähnen: deutlich verkürzte effektive Halbwertszeit; erhöhte Mengen an nicht-radioaktivem Jod im Körper des Patienten durch die fortgesetzte Gabe der (jodhaltigen) Schilddrüsenhormone; fehlender Nachweis einer Gleichwertigkeit bei der Behandlung von Metastasen; fehlende Möglichkeit, an eine Diagnostik mit Radiojod eine Therapie anzuschließen, da der TSH-Spiegel innerhalb von wenigen Tagen wieder abfällt; hohe Kosten.
Durchführung
Die Standardaktivität für die ablative Radiojodtherapie beträgt 3,7 GBq. (Dies entspricht in der veralteten Einheit Curie 100 mCi.) Wenn nach der Operation und vor der ersten (ablativen) Radiojodtherapie nennenswerte Reste von Schilddrüsengewebe verblieben sind, wird üblicherweise eine geringere Aktivität von 1,1 bis 1,85 GBq (entsprechend 30 bis 50 mCi) eingesetzt, um eine strahlenbedingte Entzündung benachbarter Gewebe zu vermeiden.
Wenn – auch nach Ausschöpfen der operativen Möglichkeiten – noch anzunehmen ist, dass bösartiges Gewebe im Körper des Patienten verblieben ist, also ein Resttumor, ein Lokalrezidiv oder Metastasen vorliegen, werden höhere Aktivitäten angewendet. Diese liegen meist im Bereich von 3,7 bis 11,1 GBq (100 bis 300 mCi), in Einzelfällen auch deutlich darüber.
Einige Tage nach der Therapie wird ein Ganzkörperszintigramm angefertigt. Die Therapie wird in etwa dreimonatigen Abständen wiederholt, bis weder das Szintigramm, das Ultraschallbild der Halsregion, noch der Tumormarker Thyreoglobulin einen Hinweis auf nennenswertes verbliebenes Schilddrüsengewebe (gutartig oder bösartig) geben. Eine Gesamt-Aktivität über alle durchgeführten Radiojodbehandlungen von bis zu 74 GBq (2000 mCi) wird bei sonst gesunden Patienten meist problemlos vertragen. Bei höherliegenden Aktivitäten ist mit einem erhöhten Risiko für eine dauerhafte Schädigung des Knochenmarks als blutbildendes Organ zu rechnen.
Bezüglich der Entlassung nach der Therapie gelten die gleichen Fristen und Grenzwerte, wie bei der Therapie gutartiger Schilddrüsenerkrankungen (siehe oben).
Risiken und Nebenwirkungen
Bei den unerwünschten Effekten der Radiojodtherapie sind die kurzfristig und akut auftretenden von den langfristig und chronisch auftretenden Nebenwirkungen zu unterscheiden und ihre jeweiligen Häufigkeiten und Tragweiten („Risiken“) zu beachten.
Im Vergleich zur Therapie gutartiger Schilddrüsenerkrankungen werden beim Schilddrüsen-Karzinom zum Teil wesentlich höhere Aktivitäten eingesetzt. Mit der erwünschten höheren Strahlendosis im Zielgewebe (Herddosis) sind damit auch höhere Strahlendosen in anderen Geweben verbunden.
Relativ häufig treten während der Therapie Appetitverlust, Veränderung der Geschmacksempfindung, Übelkeit und Speicheldrüsenreizung auf; selten finden sich Nackenschmerz oder -schwellung, Kopfschmerz oder vorübergehende Veränderungen des Blutbildes.[16]
Schwerwiegende Langzeitauswirkungen sind selten und betreffen meist Speichel- und Tränendrüsen (vor allem verminderte Tränen- bzw. Speichelproduktion), Knochenmark (sehr selten bei Patienten >45 Jahren Knochenmarksdepression oder myeloische Leukämie), Lungen (sehr selten strahleninduzierte Lungenentzündung, besonders Verschlechterung bei vorbestehender Pneumonie, bzw. Neuauftreten bei diffusen Lungenmetastasen) und Ovarien (vorübergehend fehlender Eisprung, gering erhöhte Missbildungsrate bei Schwangerschaft innerhalb des ersten Jahres nach Therapie) bzw. Hoden (Azoospermie – selten dauerhaft).[17] Der Nutzen der Radiojodtherapie übersteigt die Nebenwirkungsrate um das 4- bis 40-fache. Die zu erwartende Inzidenz von Zweitkarzinomen oder Leukämie ist dosisabhängig. Eine minimale Zunahme von Zweitkarzinomen fand sich in den Organen (Speicheldrüsen, Dickdarm und Blase), in denen sich während der Therapie vorübergehend auch Jod-131 in nennenswerter Menge ansammelt.[16] In einer englischen Studie an 7417 Patienten zeigte sich eine statistisch signifikante Abnahme des Auftretens von Krebs der Luftwege (Bronchien und Luftröhre).[16]
Die unerwünschten Wirkungen auf die Speicheldrüsen lassen sich vermindern, wenn der Patient während der Behandlung Kaugummi kaut oder saure Bonbons lutscht. Beides steigert den Speichelfluss, verkürzt die Verweildauer des radioaktiven Jods in den Speicheldrüsen und vermindert so die Strahlendosis in den Speicheldrüsen. Wenn eine strahlenbedingte Entzündungsreaktion der Speicheldrüsen (Sialadenitis) vorliegt, können die Beschwerden durch lokale Kühlung und die Einnahme von nichtsteroidalen Antirheumatika gemildert werden.[3]
Nachsorge: Radiojoddiagnostik
Radioaktives Jod dient nicht nur zur Behandlung bei Schilddrüsenkrebs, sondern auch zur Nachsorge nach Schilddrüsenoperation und ablativer Radiojodtherapie.
Der Ablauf – mit Jodkarenz, Stimulation des TSH mit anschließender Bestimmung des Tumormarkers Thyreoglobulin und oraler Gabe des Jods sowie der Durchführung der Ganzkörperszintigrafie – entspricht dem Ablauf bei der ablativen Therapie. Unterschiedlich ist dagegen die Höhe der verabreichten Aktivität, üblich sind etwa 100 bis 400 MBq Jod-131 oder 40 bis 200 MBq Jod-123.
Eine Indikation zur Radiojoddiagnostik besteht in der Regel drei bis sechs Monate nach ablativer Radiojodtherapie zur Therapiekontrolle, bei einem Anstieg des Tumormarkers Thyreoglobulin oder einem sonstigen Verdacht (zum Beispiel aufgrund des klinischen Befundes oder bildgebender Verfahren) auf einen Rückfall der Krebserkrankung (Rezidiv). Ob und wann bei Patienten, die aufgrund ihres ursprünglichen Befundes als Hoch-Risiko-Patienten (high-risk) eingestuft wurden, eine Radiojoddiagnostik auch ohne konkreten Verdacht auf ein Rezidiv sinnvoll ist, ist Gegenstand der Wissenschaft. Es existieren hierzu weder Leitlinien noch evidenzbasierte Ergebnisse.[18]
Der Nachweis von Restgewebe oder Metastasen im Rahmen der Radiojoddiagnostik führt in der Regel zu einer erneuten Radiojodtherapie.
Erfolge und Misserfolge
Die Heilungschancen sind bei den differenzierten Schilddrüsenkarzinomen im Allgemeinen überaus gut, insbesondere da diese einer Radiojodtherapie zugänglich sind. Für behandelte Patienten werden durchschnittliche 10-Jahres-Überlebensraten von über 90 % bei der papillären und etwa 80 % bei der follikulären Variante angegeben.[19] Als Prognosefaktoren gelten Patientenalter sowie Größe, Ausbreitung und histologische Differenzierung des Tumors; Lymphknotenmetastasen scheinen die Prognose nicht wesentlich zu beeinflussen. Wegen des erhöhten Rezidivrisikos ist aber eine konsequente Nachsorge besonders wichtig.
Studien mit großen Patientenzahlen und über lange Beobachtungszeiträume zeigen, dass die Radiojodtherapie die Häufigkeit von örtlichen Rückfällen (Lokalrezidiven) und das Risiko am Schilddrüsenkarzinom zu sterben (Letalität) senkt, insbesondere bei der routinemäßigen Durchführung nach der Operation.[20]
Die Ergebnisse der Radiojodtherapie bei Patienten, bei denen bereits Fernmetastasen vorliegen, sind uneinheitlich. Metastasen in Leber oder Lunge, die Jod speichern, sind gut behandelbar. Dagegen lassen sich selbst Knochenmetastasen, die gut Jod aufnehmen, kaum beeinflussen. Insgesamt wird die Radiojodtherapie bei Metastasen eingesetzt, wenn mittels Operation eine Heilung nicht mehr möglich ist. Es sollte aber vor der Radiojodtherapie versucht werden, die Gesamt-Tumormasse operativ zu reduzieren. Wenn eine (erneute) Operation möglicherweise mit erheblichen lokalen Schäden verbunden wäre, wird man sich in einzelnen Fällen bei sehr langsam wachsenden Tumoren gegen die OP mit anschließenden Radiojodtherapien entscheiden, sondern nur mit L-Thyroxin behandeln.[2]
Schwierig ist die Situation, wenn die Metastasen im Verlauf der Behandlung ihre Fähigkeit verlieren, Jod zu speichern (Entdifferenzierung). Diese Metastasen werden in der Radiojoddiagnostik nicht erkannt und durch eine Radiojodtherapie nicht erreicht. Zur Diagnose wird die Positronen-Emissions-Tomographie (PET) mit Fluordesoxyglucose (FDG) eingesetzt. Da auch Chemotherapie und Strahlentherapie keine Heilung ermöglichen, wird versucht mit Gaben von Isotretinoin eine Re-Differenzierung zu erreichen. Die anschließende Radiojodtherapie zeigt in etwa 20 bis 35 % der Fälle zumindest Teilerfolge.[2]
Geschichte

Im Vorfeld des Einsatzes der Radiojodtherapie wurde beim Schilddrüsenkarzinom postoperativ eine Nachbestrahlung (mit Röntgenstrahlen) allgemein eingesetzt und als effektiv angesehen.[21][22] Die Diagnose des Schilddrüsenkarzinoms bereitete jedoch noch Mitte des letzten Jahrhunderts große Probleme,[23] sodass Begriffsüberschneidungen in der Literatur dieser Zeit wahrscheinlich sind.
1939 und 1940 veröffentlichte Joseph G. Hamilton Arbeiten über den Jodmetabolismus der Schilddrüse, wobei er radioaktives Jod bei gesunden Probanden und solchen mit Struma unterschiedlicher Pathogenese einsetzte.[24][25] Bereits in den Vorjahren hatte er zur Wirkung von Radioaktivität auf den menschlichen Körper geforscht.[26][27]
1942 veröffentlichten Saul Hertz vom Massachusetts General Hospital und der Physiker Arthur Roberts ihren Bericht über die erste Radiojodtherapie (1941) beim Morbus Basedow,[28][29] damals noch überwiegend mit dem Isotop Jod-130 (Halbwertszeit 12,4 Stunden).[30] Wenige Monate später – ebenfalls 1941 – führten Joseph Hamilton und John H. Lawrence die erste Therapie mit Jod-131 durch – dem Isotop, das auch heute noch verwendet wird.[30] 1942 beschrieben A. S. Keston und Mitarbeiter in einer Falldarstellung die aus therapeutischen und diagnostischen Zwecken durchgeführte Anwendung radioaktiven Jods bei einer im Oberschenkelknochen sitzenden Metastase eines Schilddrüsenkarzinoms, das auf die damals übliche Therapie mit Röntgenstrahlen nicht angesprochen hatte.[31] Eine andere Kasuistik aus dem Jahr 1942 zeigt, dass es sich dabei noch keineswegs um ein Routinevorgehen beim Schilddrüsenkarzinom handelte.[32]
Samuel M. Seidlin (1895–1955, damals Leiter der endokrinologischen Abteilung des Montefiore Hospitals in New York City) setzte 1946 erstmals Jod-131 bei Schilddrüsenkrebs mit Metastasen ein.[33][34]
Die erste Radiojodtherapie beim Schilddrüsenkarzinom in Europa wurde 1948 am Luisen-Hospital Aachen durch Cuno Winkler durchgeführt.[35]
Literatur
- F. Grünwald, C. Menzel. Radioiodtherapie. In: T. Kuwert, F. Grünwald, U. Haberkorn, T. Krause: Nuklearmedizin. Stuttgart / New York 2008, ISBN 978-3-13-118504-4.
- Medizinische Leitlinien:
- Leitlinie Radioiodtherapie (RIT) bei benignen Schilddrüsenerkrankungen der Deutschen Gesellschaft für Nuklearmedizin (DGN). In: AWMF online (Stand 10/2015)
- Leitlinie Verfahrensanweisung zum Radioiodtest. der Deutschen Gesellschaft für Nuklearmedizin (DGN). In: AWMF online (Stand 10/2014)
- Leitlinie Verfahrensanweisung zur Radioiodtherapie (RIT) beim differenzierten Schilddrüsenkarzinom. der Deutschen Gesellschaft für Nuklearmedizin (DGN). In: AWMF online (Stand 10/2015)
- Leitlinie Verfahrensanweisung für die Iod-131-Ganzkörperszintigraphie beim differenzierten Schilddrüsenkarzinom. der Deutschen Gesellschaft für Nuklearmedizin (DGN). In: AWMF online (Stand 07/2017)
Weblinks
- L.-A. Hotze:Die Geschichte der Radiojodtherapie. ( vom 24. Juni 2010 im Internet Archive)
Einzelnachweise
- ↑ Frank Grünwald, Karl-Michael Derwahl: Diagnostik und Therapie von Schilddrüsenerkrankungen. Frankfurt / Berlin 2014, ISBN 978-3-86541-538-7, S. 109.
- ↑ a b c d e f g h i j k l m n o p q F. Grünwald, C. Menzel: Radioiodtherapie. In: T. Kuwert, F. Grünwald, U. Haberkorn, T. Krause: Nuklearmedizin. Stuttgart / New York 2008, ISBN 978-3-13-118504-4.
- ↑ a b Lothar-Andreas Hotze, Petra-Maria Schumm-Draeger: Schilddrüsenkrankheiten. Diagnose und Therapie. Berlin 2003, ISBN 3-88040-002-4.
- ↑ a b Leitlinie der Deutschen Gesellschaft für Nuklearmedizin (DGN): Radioiodtherapie (RIT) bei benignen Schilddrüsenerkrankungen.
- ↑ M. E. Peterson: Radioiodine treatment of hyperthyroidism. In: Clin. Tech. Small Anim. Pract., 21(1)/2006, S. 34–39, PMID 16584029, ISSN 1096-2867
- ↑ a b Richtlinie „Strahlenschutz in der Medizin“ (verwaltungsvorschriften-im-internet.de); abgerufen am 25. März 2018.
- ↑ L. D. Marinelli, E. H. Quimby, G. J. Hine: Dosage determination with radioactive isotopes; practical considerations in therapy and protection. In: The American journal of roentgenology and radium therapy. Band 59, Nr. 2, 1948, S. 260–281, PMID 18905884.
- ↑ Leitlinie der Deutschen Gesellschaft für Nuklearmedizin (DGN): Verfahrensanweisung zum Radioiodtest. (awmf.org).
- ↑ a b I. S. Robertson: Dosimetry of radionuclides. In: S. Falk (Hrsg.): Thyroid disease. Raven, New York 1997. Zitiert nach: F. Grünwald, C. Menzel. Radioiodtherapie. In: T. Kuwert, F. Grünwald, U. Haberkorn, T. Krause: Nuklearmedizin. Stuttgart, New York 2008, ISBN 978-3-13-118504-4.
- ↑ P. Hall, G. Lundell, A. Mattsson, K. Wiklund, L. -E. Holm, M. Lidberg, J. D. Boice, G. Berg, G. Bjelkengren, U. -B. Ericsson, A. Hallquist, J. Tennvall: Leukaemia incidence after iodine-131 exposure. In: The Lancet. Band 340, Nr. 8810, 1992, S. 1–4, doi:10.1016/0140-6736(92)92421-B, PMID 1351599.
- ↑ Elaine Ron, Michele Morin Doody, David V. Becker, A. Bertrand Brill, Rochelle E. Curtis, Marlene B. Goldman, Benjamin S. H. Harris III, Daniel A. Hoffman, William M. McConahey, Harry R. Maxon, Susan Preston-Martin, M. Ellen Warshauer, F. Lennie Wong, John D. Boice, for the Cooperative Thyrotoxicosis Therapy Follow-up Study Group: Cancer Mortality Following Treatment for Adult Hyperthyroidism. In: JAMA. Band 280, Nr. 4, 1998, S. 347–355, PMID 9686552 (Cancer Mortality Following Treatment for Adult Hyperthyroidism).
- ↑ Radioactive Iodine. Information der American Thyroid Association, abgerufen am 5. Oktober 2012.
- ↑ Art. 37 der Verordnung über den Umgang mit offenen radioaktiven Strahlenquellen bei admin.ch; abgerufen am 20. März 2011.
- ↑ Anhang 5 der Verordnung über den Umgang mit offenen radioaktiven Strahlenquellen bei admin.ch; abgerufen am 20. März 2011.
- ↑ a b c d Radioiodtherapie beim differenzierten Schilddrüsenkarzinom. Abgerufen am 9. Januar 2016.
- ↑ a b c S. M. Chow: Side effects of high-dose radioactive iodine for ablation or treatment of differentiated thyroid carcinoma. In: Hong Kong College Radiologist. Nr. 8, 2005, S. 127–135 (archive.org [PDF; 81 kB]).
- ↑ D. J. Handelsman, A. J. Conway, P. E. Donnelly, J. R. Turtle: Azoospermia after iodine-131 treatment for thyroid carcinoma. In: British Medical Journal. 281, Nr. 6254, 1980, S. 1527, PMC 1714914 (freier Volltext).
- ↑ Leitlinie der Deutschen Gesellschaft für Nuklearmedizin (DGN): Verfahrensanweisung für die Iod-131 Ganzkörper-Szintigraphie beim differenzierten Schilddrüsenkarzinom. (online).
- ↑ Österreichische Gesellschaft für Chirurgische Onkologie: Prognose des differenzierten (papillären, follikulären) Schilddrüsenkarzinoms ( vom 5. März 2009 im Internet Archive)
- ↑ N. A. Saamann et al.: The results of various modalities of treatment of well differentiated thyroid carcinoma; a retrospective review of 1599 patients. In: J Clin Endocrinol. Band 75, 1992, S. 147–154. und E. L. Mazzaferri, S. M. Jhiang: Longterm impact of initial surgery and medical therapy on papillary and follicular thyroid cancer. In: Am J Med. Band 97, 1994, S. 418–428. zitiert nach F. Grünwald, C. Menzel. Radioiodtherapie. In: T. Kuwert, F. Grünwald, U. Haberkorn, T. Krause: Nuklearmedizin. Stuttgart, New York 2008, ISBN 978-3-13-118504-4.
- ↑ A. M. Smith: Carcinoma of the Thyroid. In: Virginia M. Monthly. 69, 1942, S. 318–324 (Abstract (PDF) Cancer Res., 1943; 3, S. 729–808; abgerufen am 19. Dezember 2009).
- ↑ E. T. Leddy: The Roentgen Ray Treatment of Malignant Tumors. In: M. Clin. North Amerika. 25, 1941, S. 973–1009 (Abstract (PDF) Cancer Res., 1943; 3, S. 425–496; abgerufen am 19. Dezember 2009).
- ↑ C. Bonne: Over Maligne Schildkliergezwellen (Malignant tumors of the thyroid). In: South African M, J. 15, 1941, S. 147–152 (Abstract (PDF) Cancer Res., 1943; 3, S. 281–352; abgerufen am 19. Dezember 2009).
- ↑ Joseph G. Hamilton, Mayo H. Soley: Studies in iodine metabolism of the thyroid gland in situ by the use of radio-iodine in normal subjects and in patients with various types of goiter. In: American Journal of Physiology. 131, 1940, S. 135–143.
- ↑ Joseph G. Hamilton and Mayo H. Soley: Studies in iodine metabolism by the use of a new radioactive isotope of iodine. In: American Journal of Physiology. 127, 1939, S. 557–572.
- ↑ Joseph G. Hamilton, Gordon A. Alles: The physiological action of natural and artificial radioactivity. In: American Journal of Physiology. 125, 1939, S. 410–413.
- ↑ Joseph G. Hamilton: The rates of absorption of the radioactive isotopes of sodium, potassium, chlorine, bromine, and iodine in normal human subjects. In: American Journal of Physiology. 124, 1938, S. 667–678.
- ↑ S. Hertz, A. Roberts: Application of radioactive iodine in therapy of Graves’ disease. In: J Clin Invest. Band 21, Nr. 6, 1942, S. 624. zitiert nach: Martin Metten: Die Auswirkung der Dosisleistung auf den Therapieerfolg der Radiojodtherapie bei funktionellen Schilddrüsenautonomien. DNB 96838837x (Dissertation, 2002, Justus-Liebig-Universität Giessen).
- ↑ Ralf Paschke, Peter Georgi: Therapie der uni- oder multifokalen Schilddrüsenautonomie. (PDF) In: Dtsch Arztebl. 97, Nr. 47, 2000, S. A-3197, abgerufen am 19. Dezember 2009.
- ↑ a b L.-A. Hotze. Die Geschichte der Radiojodtherapie. Archiviert vom am 24. Juni 2010; abgerufen am 31. Dezember 2009.
- ↑ A. S. Keston, R. P. Ball, V. X. Frantz, W. W. Palmer: Storage of radioactive iodine in a metastasis from thyroid carcinoma. In: Science. 95, 1942, S. 362–363, doi:10.1126/science.95.2466.362 (Abstract (PDF; 793 kB) Cancer Res., 1943; 3, S. 281–352; abgerufen am 19. Dezember 2009).
- ↑ H. T. Wikle, A. J. Ritzmann: The course of carcinoma of the thyroid gland. Report of an unusual case. In: Am J Surg 5, Nr. 6, 1942, S. 507–512 doi:10.1016/S0002-9610(42)90721-9 (Abstract (PDF; 793 kB) Cancer Res., 1943; 3, S. 281–352; abgerufen am 19. Dezember 2009).
- ↑ S. M. Seidlin, L. D. Marinelli, E. Oshry: Radioactive iodine therapy: effect on functioning metastases of adenocarcinoma of the thyroid. In: JAMA. Band 132, 1946, S. 838.
- ↑ E. Siegel: The beginnings of radioiodine therapy of metastatic thyroid carcinoma: a memoir of Samuel M. Seidlin, M.D. (1895–1955) and his celebrated patient. In: Cancer Biother Radiopharm. Band 14, 1999, S. 71.
- ↑ C. Winkler: Radioaktives Jod zur Behandlung bösartiger Schilddrüsengeschwülste. In: Verh Dtsch Ges Inn Med. Band 56, 1950, S. 180. zitiert nach L.-A. Hotze. Die Geschichte der Radiojodtherapie. Archiviert vom am 24. Juni 2010; abgerufen am 7. Februar 2012.
Auf dieser Seite verwendete Medien
Autor/Urheber: Drahreg01, Lizenz: CC BY-SA 3.0
Ganzkörperszintigrafie im Rahmen einer Radioioddiagnostik mit 370 MBq 131Iod bei Schilddrüsenkarzinom. Kein Nachweis einer Speicherung in der Schilddrüsenregion.
Autor/Urheber: Drahreg01, Lizenz: CC BY-SA 3.0
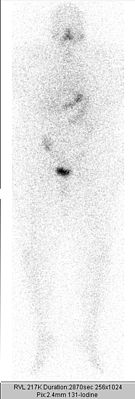
Ganzkörperszintigrafie nach 2. ablativer Radioiodtherapie mit 3,7 GBq 131Iod bei Schilddrüsenkarzinom. Geringe Speicherung in der Restschilddrüse.
Autor/Urheber: Die Autorenschaft wurde nicht in einer maschinell lesbaren Form angegeben. Es wird KGH als Autor angenommen (basierend auf den Rechteinhaber-Angaben)., Lizenz: CC BY-SA 3.0
Histopatholgical image of papillary carcinoma of the thyroid gland obtained by a total thyroidectomy. Hematoxylin and eosin stain. At higher magnification of an accompanying file "Thyroid_papillary_carcinoma_histopathology_(2).jpg".
Autor/Urheber: Drahreg01, Lizenz: CC BY-SA 3.0
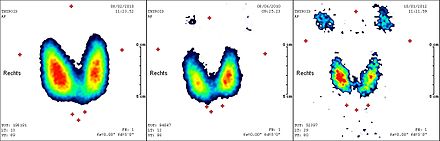
;Serie von Schilddrüsenszintigrafien mit 99mTechnetium bei Morbus Basedow: (von links nach rechts)
- 1 Monat vor Radiojodtherapie
- 3 Monate nach Radiojodtherapie
- 10 Monate nach Radiojodtherapie
Dr. Robert Marshak drinking radioactive sodium.
Robert Marshak drinking radiosodium in January 1939 and Joseph Hamilton (right). Soon after he began his search for useful radioisotopes, Lawrence had the good luck to make sodium-24 efficiently by bombarding rock salt with deuterons. The new substance runs through the body like ordinary sodium; its convenient half-life, fifteen hours, made it useful in diagnosis and therapy. "My medical friends tell me that the properties of radiosodium are almost ideal for many medical applications, such as the treatment of cancer." Lawrence predicted that sodium-24 would supersede radium, and to make sure he promoted it on a national lecture tour. A volunteer-the first two were Alvarez and Joseph Hamilton of the University's hospital in San Francisco-would down a solution of the isotope, and Lawrence would track its course through his body. Lawrence received fresh supplies of sodium-24 by air mail just in time for these lectures, which increased the drama, and the value, of radioisotopes. (The preceding information was excerpted from the text of the Fall 1981 issue of LBL Newsmagazine.)Structure of (S)-2-amino-3-(4-(4-hydroxy-3,5-diiodophenoxy)-3,5-diiodophenyl)propanoic acid
Autor/Urheber: Drahreg01, Lizenz: CC BY-SA 3.0
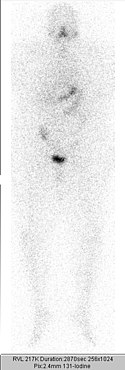
Ganzkörperszintigrafie nach 3. ablativer Radioiodtherapie mit 3,7 GBq 131Iod bei Schilddrüsenkarzinom. Minimale Speicherung in der Restschilddrüse.
Autor/Urheber: Drahreg01, Lizenz: CC BY-SA 4.0
Bleibehälter (rechts) für flüssiges 131I-Natriumiodid, Höhe etwa 10 cm, und Umverpackung (links, Weißblech und Styropor); es fehlt die zweite Umverpackung (Pappe).
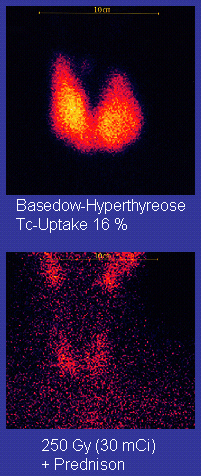
Autor/Urheber: MBq, Lizenz: Copyrighted free use
Beschreibung: Technetium-Szintigraphie der Halsregion bei einem Patienten mit Morbus Basedow vor und nach Radioiodtherapie.
Autor/Urheber: Drahreg01, Lizenz: CC BY-SA 3.0
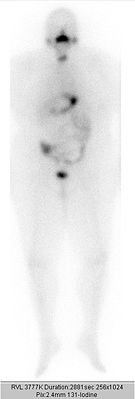
Ganzkörperszintigrafie nach 1. ablativer Radioiodtherapie mit 3,7 GBq 131Iod bei Schilddrüsenkarzinom. Intensive Speicherung in der Restschilddrüse.