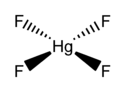
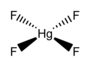
Quecksilber(IV)-fluorid
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Allgemeines | |||||||
| Name | Quecksilber(IV)-fluorid | ||||||
| Andere Namen |
| ||||||
| Summenformel | HgF4 | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 276,58 g·mol−1 | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
Quecksilber(IV)-fluorid ist die erste Quecksilber-Verbindung mit der Oxidationszahl +4, von der berichtet wurde. Quecksilber hat wie die anderen Elemente aus der Zinkgruppe (Cadmium und Zink) eine Elektronenkonfiguration von s2d10 und geht normalerweise nur Bindungen mit seinem 6s-Orbital ein. Daher erreicht Quecksilber normalerweise höchstens die Oxidationszahl +2.[2] Über die Existenz von HgF4 wurde erstmals nach Experimenten im Jahr 2007 berichtet, jedoch ist die Existenz weiterhin umstritten; bei im Jahr 2008 durchgeführten Experimenten gelang es nicht, die Verbindung herzustellen.[3]
Geschichte
Bereits seit den 1970ern wurde über höhere Oxidationszahlen von Quecksilber spekuliert und in den 1990ern ergaben theoretische Berechnungen, dass solche Verbindungen mit der Konfiguration d8 in der Gasphase stabil sein sollten.[2][4] Jedoch gelang es erst 2007, mithilfe von festem Neon über das Verfahren der Matrixisolation bei einer Temperatur von 4 K durch UV-Bestrahlung von Quecksilber in Gegenwart von Fluor HgF4 herzustellen. Die Verbindung wurde durch Infrarotspektroskopie nachgewiesen.[5][6][7] Die Dichtefunktionaltheorie und Coupled-Cluster-Berechnungen zeigten, dass die d-Orbitale an der Bindung beteiligt waren, was zu dem Vorschlag führte, dass Quecksilber als Übergangsmetall betrachtet werden sollte.[4] Diese Schlussfolgerung wurde jedoch von W. B. Jensen infrage gestellt, da HgF4 nur unter ungewöhnlichen Nichtgleichgewichtsbedingungen existiert und daher als Ausnahme betrachtet werden sollte.[8]
Theoretische Studien legen nahe, dass Quecksilber das einzige natürlich vorkommende Element aus der Zinkgruppe ist, das Tetrafluoride bildet, was auf relativistische Effekte zurückzuführen ist. Berechnungen zufolge sind die Tetrafluoride der „weniger relativistischen“ Elemente Cadmium und Zink instabil, wohingegen das Tetrafluorid des „relativistischeren“ künstlich erzeugten Coperniciums den Vorhersagen zufolge stabiler sein sollte.[4][9] Neuere Studien werfen jedoch Zweifel an der Möglichkeit der Existenz von Quecksilber(IV)-fluorid und Copernicium(IV)-fluorid auf.[10]
Gewinnung und Darstellung
HgF4 wird durch Reaktion von elementarem Quecksilber mit Fluor gewonnen:[5]
Eigenschaften
HgF4 ist nur bei Matrixisolation und einer Temperatur von 4 K (−269 °C) stabil; bei Erhitzen oder wenn sich die HgF4-Moleküle berühren, zerfällt die Verbindung in Quecksilber(II)-fluorid und Fluor:
HgF4 ist ein diamagnetisches, quadratisch-planares Molekül.[2] Das Quecksilber-Atom hat die Elektronenkonfiguration 6s25d86p6 und folgt somit der Oktettregel, jedoch nicht der 18-Elektronen-Regel. HgF4 ist isoelektronisch zum Tetrafluorogoldsäure-Anion AuF4− und ist valenzisoelektronisch zu den Tetrachlorogoldsäure-, (AuCl4−) Tetrabromogoldsäure- (AuBr4−) und Tetrachloridoplatinat-Anionen (PtCl42−).
Weblinks
Einzelnachweise
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c Martin Kaupp, Hans Georg von Schnering: Molekulares Quecksilber(IV)-fluorid, HgF4: eine ab-initio-Untersuchung. In: Angew. Chem. Band 105, Nr. 6. VCH, Weinheim 1993, S. 952–954 (uni-wuerzburg.de [PDF]).
- ↑ Is mercury a transition metal? (Memento vom 12. Oktober 2016 im Internet Archive)
- ↑ a b c Xuefang Wang, Lester Andrews, Sebastian Riedel, Martin Kaupp: Mercury Is a Transition Metal: The First Experimental Evidence for HgF4. In: Angew. Chem. Int. Ed. 46. Jahrgang, Nr. 44, 2007, S. 8371–8375, doi:10.1002/anie.200703710, PMID 17899620.
- ↑ a b Eintrag zu Quecksilber. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. April 2021.
- ↑ High Oxidation States: Mercury tetrafluoride synthesized.
- ↑ Elusive Hg(IV) species has been synthesized under cryogenic conditions. 12. Oktober 2007.
- ↑ William B. Jensen: Is Mercury Now a Transition Element? In: J. Chem. Educ. 85. Jahrgang, Nr. 9, 2008, S. 1182–1183, doi:10.1021/ed085p1182, bibcode:2008JChEd..85.1182J.
- ↑ Darleane C. Hoffman, Diana M. Lee, Valeria Pershina: The Chemistry of the Actinide and Transactinide Elements. Hrsg.: Morss, Norman M. Edelstein, Jean Fuger. Springer Science+Business Media, Dordrecht, Niederlande edition=3. 2006, ISBN 1-4020-3555-1, Transactinides and the future elements.
- ↑ Erkki J. Brändas, Eugene S. Kryachko: Fundamental World of Quantum Chemistry: A Tribute to the Memory of Per-Olov Löwdin. 2013, ISBN 978-94-017-0448-9 (google.com).
Auf dieser Seite verwendete Medien
The structure of HgF4 drawn in ChemDraw by me