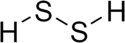Polysulfane
Polysulfane (Polyschwefelwasserstoffe) sind kettenförmige chemische Verbindungen aus Schwefel und Wasserstoff mit der Formel H-Sn-H. Die Ausgangsverbindung Monosulfan mit n = 1 ist allgemein bekannt unter dem Namen Schwefelwasserstoff. Bekannt sind Verbindungen mit Werten für n zwischen 2 und 18.[1]
Gewinnung und Darstellung
Bei der Reaktion einer Lösung eines Polysulfids (z. B. eines Natriumpolysulfids[2]) unter Kühlung mit Salzsäure
oder der Zersetzung von festen Polysulfiden mit wasserfreier Ameisensäure, so scheidet sich gelbes Rohsulfan ab, das aus einer Mischung von Polysulfanen (n <=8 ) besteht, die durch Hochvakuumdestillation in seine Bestandteile zerlegt werden können.[1]
Die Umsetzung von Dichlorpolysulfanen mit der stöchiometrisch doppelten Menge an Mono- oder Polysulfanen ergibt höhere Polysulfane.[1]
Eigenschaften
Alle Polysulfane sind farblose bis gelbliche, stechend riechende Flüssigkeiten, die leicht löslich in Kohlenstoffdisulfid sind. Sie sind thermodynamisch instabil und zerfallen in Schwefelwasserstoff und Schwefel. Basen, als auch Ammoniak und Quarzpulver[3], wirken als Zersetzungskatalysatoren, weshalb Polysulfane von Alkalilaugen heftig zersetzt werden.[1]
Sie sind schwache Säuren.[2]
| Name | Formel | CAS | Beschreibung[1] | Dichte[1][4] | Schmelztemperatur[1] | Siedetemperatur[1] | |
|---|---|---|---|---|---|---|---|
| Disulfan | H2S2 | 13465-07-1 | farblose Flüssigkeit | 1,376 g·cm−3 | −89,6 °C | 70,7 °C | |
| Trisulfan | H2S3 | 13845-23-3 | hellgelbe Flüssigkeit | 1,491 g·cm−3 | −53 °C | 90 °C (Zersetzung) | |
| Tetrasulfan | H2S4 | hellgelbe Flüssigkeit | 1,588 g·cm−3 | −85 °C | |||
| Pentasulfan | H2S5 | hellgelbe Flüssigkeit | 1,660 g·cm−3 | 40 °C (Zersetzung) | |||
| Hexasulfan | H2S6 | gelbe Flüssigkeit | 1,699 g·cm−3 | ||||
| Heptasulfan | H2S7 | 1,721 g·cm−3 | |||||
| Octasulfan | H2S8 | 1,747 g·cm−3 |
Verwendung
Bedeutung haben Polysulfane für Kondensationsreaktionen zur Synthese anderer chemischer Verbindungen, zum Beispiel von Schwefelringen.[2]
Einzelnachweise
- ↑ a b c d e f g h A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 560.
- ↑ a b c Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022566-2, S. 446 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Ralf Steudel: Chemie der Nichtmetalle: mit Atombau, Molekülgeometrie und Bindungstheorie. Walter de Gruyter, 1998, ISBN 3-11-015902-3, S. 284 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 364.
Auf dieser Seite verwendete Medien
chemical structure of hydrogen disulfide (disulphide)