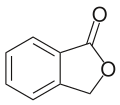
Phthalid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Phthalid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C8H6O2 | ||||||||||||||||||
| Kurzbeschreibung | farbloses bis gelbliches Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 134,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 1,1613 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 290 °C[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex | 1,536 (99 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Phthalid ist eine Chemikalie, die sowohl synthetisch hergestellt wird als auch als sekundärer Pflanzenstoff vorkommt. Die Phthalidderivate 3-Butylphthalid und Sedanolid kommen beispielsweise in Sellerie[4] und Liebstöckel[5] vor.
Gewinnung und Darstellung
Phthalid kann durch Reaktion von Phthalimid mit Natriumhydroxid mit einer Beimischung von Zink sowie Kupfersulfat und anschließender Reaktion des Zwischenproduktes mit Chlorwasserstoff gewonnen werden.[6]
Allgemein können Phthalide aus 2-Formyl-arylketonen in Dimethylsulfoxid (DMSO) entweder durch eine Cannizarro-Tischtschenko-Reaktion unter nukleophiler Katalyse (NaCN) oder unter photochemischen Bedingungen gewonnen werden.[7]
Verwendung
Phthalid ist ein Grundstoff für viele andere Synthesen, z. B. von Kresoxim-methyl und Picoxystrobin. 2013 wurde erstmals die Nutzbarkeit von Phthalid in der Suzuki-Kupplung nachgewiesen.[8]
Derivate
Tetrachlorphthalid (Rabcide)
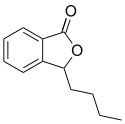
Butylphthalid
Einzelnachweise
- ↑ a b c d e Eintrag zu CAS-Nr. 87-41-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. April 2013. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-308.
- ↑ a b Datenblatt Phthalide bei Sigma-Aldrich, abgerufen am 17. April 2013 (PDF).
- ↑ Butyl Phthalide
- ↑ Lehrbuch Lebensmittelchemie und Ernährung in der Google-Buchsuche.
- ↑ J. H. Gardner und C. A. Naylor jr.: Phthalide In: Organic Syntheses. 16, 1936, S. 71, doi:10.15227/orgsyn.016.0071; Coll. Vol. 2, 1943, S. 26 (PDF).
- ↑ D. C. Gerbino, D. Augner, N. Slavoy, H.-G. Schmalz: Phthalide synthesis. In: Org. Lett., 2012, 14, 2338–2341.
- ↑ James McNulty, Kunal Keskar: Phthalide: a direct building-block towards P,O and P,N hemilabile ligands. Application in the palladium-catalysed Suzuki-Miyaura cross-coupling of aryl chlorides. In: Organic & Biomolecular Chemistry. 11, 2013, S. 2404, doi:10.1039/C3OB40198G.
Auf dieser Seite verwendete Medien
Struktur von Phenolphthalein
Chemical structure of 4,5,6,7-tetrachlorophthalide (phthalide, fthalide, Rabcide
Chemical structure of butylphthalide (3-n-Butylphthalide; NBP; BuPh; Butyl-phthalide
Phthalide