Phosphabenzol
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
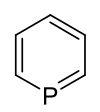 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Phosphabenzol | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C5H5P | ||||||||||||
| Kurzbeschreibung | farblose flüchtige Flüssigkeit mit einem charakteristischen Phosphingeruch[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 96,07 g·mol−1 | ||||||||||||
| Aggregatzustand | flüssig[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Phosphabenzol ist ein aromatischer Heterocyclus, der neben Kohlenstoff und Wasserstoff ein Phosphoratom enthält. Die Summenformel lautet C5H5P. Es ist das schwerere Homologe von Pyridin. Andere gebräuchliche Namen sind Phosphinin oder Phosphorin.
Darstellung
Als erstes Phosphabenzolderivat wurde 1966 von Gottfried Märkl das 2,4,6-Triphenylphosphabenzol beschrieben. Die Synthese erfolgt durch Umsetzung von 2,4,6-Triphenylpyryliumtetrafluoroborat[3] mit Tris(hydroxymethyl)phosphin[4] in Pyridin.[5]
Weitere Phosphabenzolderivate sind durch Umsetzung verschiedener Pyriliumjodide mit Tris(trimethylsilyl)phosphan zugänglich[6]
Einen Syntheseweg zum nichtsubstituierten Phosphabenzol beschrieb 1971 Arthur Ashe III.[7][1] Durch die Kupplung von Propargylbromid 1 mit Acetylenmagnesiumbromid 2 erhält man Penta-1,4-diin 3, das mit Dibutylzinnhydrid zu 1,4-Dihydro-1,1-dibutylzinnbenzol 4 umgesetzt wird. Die Reaktion dieser Zwischenstufe mit Phosphortribromid ergibt das Phosphanbromid 5. Die anschließende Dehydrohalogenierung mit Diazabicyclononen (DBN) liefert das Phosphabenzol 6.
Francois Mathey, einer der weltweit führenden Phosphorchemiker, entwickelte die Ashe‘schen Methoden unter Einbeziehung von Übergangsmetallkomplexverbindungen einschließlich Palladium- bzw. Nickel-katalysierter Kupplungsreaktionen weiter.
Eigenschaften
Physikalische Eigenschaften
Phosphabenzol ist eine farblose flüchtige Flüssigkeit mit einem charakteristischen Phosphingeruch. Sie ist luftempfindlich, scheint aber unter einer inerten Atmosphäre recht stabil zu sein.[1]
Das Molekül der Verbindung hat eine planare Struktur, die etwa 88 % der Aromatizität des Benzols aufweist. Die P–C-Bindungslänge beträgt 173 pm und die C–C-Bindungslängen liegen im Bereich von 140 pm.[8]
Chemische Eigenschaften
Phosphabenzol ist relativ stabil, wenig luft- und feuchtigkeitsempfindlich und kann lange unter Inertgasatmosphäre gelagert werden. Im Gegensatz hierzu ist beispielsweise Silabenzol sehr luft- und feuchtigkeitsempfindlich sowie thermolabil. Die Stabilität der Titelverbindung hängt mit den ähnlichen Elektronegativitäten von Kohlenstoff (2,5) und Phosphor (2,1) zusammen.
Obwohl Phosphabenzol das schwere Homologe zum Pyridin ist, gibt es entscheidende Unterschiede dieser Verbindungen. Das freie Elektronenpaar des N im Pyridin ist dessen HOMO, sodass Pyridin über gute σ-Donoreigenschaft verfügt.
Das HOMO und LUMO von Phosphabenzol jedoch sind dessen π und π* Molekülorbitale, außerdem ist das freie Elektronenpaar in einem niedrigeren Energieniveau lokalisiert. Aus diesem Grund fungiert Phosphabenzol eher als σ-Akzeptor- und π-Donorligand.
Pyridin reagiert mit Nucleophilen überwiegend in der C2-Position wegen der höheren Elektronegativität des Stickstoffatoms. Phosphabenzol hingegen bildet mit Nucleophilen λ4-Derivate, die wiederum mit Elektrophilen zu λ5-Phosphabenzolen reagieren.[9]
Homologe des Phosphabenzols
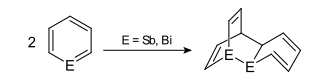
Vom Pyridin und Phosphabenzol sind die homologen Verbindungen schwererer Elemente bekannt. Allen ist ihre Aromatizität gemeinsam. Die Stabilität nimmt mit der Ordnungszahl des Heteroatoms ab. Nachfolgend sind die Bindungslängen und -winkel der Heterobenzole der 15. Gruppe des Periodensystems dargestellt (von links nach rechts: Pyridin, Phosphabenzol, Arsabenzol, Stibabenzol und Bismabenzol):[10]
Die mit steigender Ordnungszahl zunehmende Instabilität hängt damit zusammen, dass eine [4+2]-Cycloaddition bevorzugt schon bei niedrigen Temperaturen abläuft und die Isolierung der Reinsubstanzen z. T. unmöglich gestaltet.
Bei elektrophilen Substitutionsreaktionen wie Halogenierung, Acylierung usw. verhält sich Phosphabenzol wie andere aromatische Verbindungen.
Eine Zusammenstellung von Eigenschaften, Synthesen und Reaktionen der Homologen Phosphabenzol und Arsabenzol lieferte Gottfried Märkl 1982.[11]
Übergangsmetallkomplexe
Vom Phosphabenzol sind viele Übergangsmetallkomplexe bekannt. Zu diesen gehören auch gemischte Phosphazen/Phosphabenzo-Liganden, die von Mathey[12] untersucht wurden. Phosphabenzol-Rhodium-Systeme scheinen bei der Hydroformylierung von terminalen wie internen Olefinen den herkömmlichen Katalysatoren überlegen zu sein.[13]
Der Marburger Organometallchemiker und Buchautor Christoph Elschenbroich bespricht in seinem Buch weitere Phosphabenzol-Komplexverbindungen, in denen der Ligand sowohl als η1-, als auch als η6-Ligand fungiert. So ist (η1-C5H5P)-Mo(CO)5 von Ashe bereits 1977 beschrieben worden. Andere Übergangsmetalle bilden eher Komplexe wie beispielsweise (η6-RnC5H5-nP)nCr(CO)6-n, welches von Nöth 1973 synthetisiert wurde.
Einzelnachweise
- ↑ a b c d Arthur J. Ashe: Phosphabenzene and arsabenzene. In: Journal of the American Chemical Society. Band 93, Nr. 13, Juni 1971, S. 3293, doi:10.1021/ja00742a038.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,4,6-Triphenylpyryliumfluoroborat: CAS-Nummer: 448-61-3, EG-Nummer: 207-186-4, ECHA-InfoCard: 100.006.535, PubChem: 9930615, ChemSpider: 8106246, Wikidata: Q72514832.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Tris(hydroxymethyl)phosphin: CAS-Nummer: 2767-80-8, EG-Nummer: 220-445-6, ECHA-InfoCard: 100.018.587, PubChem: 76001, ChemSpider: 68500, Wikidata: Q27294320.
- ↑ G. Märkl: 2,4,6-Triphenylphosphabenzol. In: Angewandte Chemie. Band 78, Nr. 18-19, 21. September 1966, S. 907, doi:10.1002/ange.19660781817.
- ↑ G. Märkl, F. Lieb, A. Merz: Eine neue Synthese von Derivaten des Phosphabenzols. In: Angewandte Chemie. Band 79, Nr. 10, 21. Mai 1967, S. 475, doi:10.1002/ange.19670791014.
- ↑ Arthur J. Ashe, Paul Shu: 1-Phenylborabenzene anion. In: Journal of the American Chemical Society. Band 93, Nr. 7, April 1971, S. 1804, doi:10.1021/ja00736a052.
- ↑ Trinity University Cheminformatics: Distances About the Ring (Memento vom 10. März 2005 im Internet Archive).
- ↑ Ashe III, Smith: The reaction of phosphabenzene, arsabenzene and stibabenzene with methyllithium.
- ↑ Christoph Elschenbroich: Organometallchemie. 6. Auflage. Teubner Verlag, Wiesbaden 2008 (eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 25. Februar 2010]).
- ↑ Gottfried Märkl: Phosphabenzol und Arsabenzol. Die höheren Elementhomologen des Pyridins. Chemie in unserer Zeit 16 (1982) 139–148, doi:10.1002/ciuz.19820160503.
- ↑ Sava, Mézailles, Maigrot, Nief, Ricard, Mathey, Floch: A Versatile Approach toward Phosphinine-Phosphole-Based and Phosphinine-Phosphaferrocene-Based Tridentate Ligands.
- ↑ Lothar Weber: Phosphorheterocyclen: von Laborkuriositäten zu Liganden in hocheffizienten Katalysatoren. In: Angewandte Chemie. 114, 2002, S. 583–592, doi:10.1002/1521-3757(20020215)114:4<583::AID-ANGE583>3.0.CO;2-2.
Literatur
- Christoph Elschenbroich, A. Salzer: Organometallchemie. Teubner Taschenbücher Chemie 1990, ISBN 3-519-23501-3.
- Louis D. Quin: A Guide to Organophosphorus Chemistry . Wiley-Interscience 2000, ISBN 0-471-31824-8.
Auf dieser Seite verwendete Medien
Homologe des Phosphabenzols
Bindungslängen und -winkel von verschiedenen Heterobenzolen der 15. Gruppe (von links nach rechts: Pyridin, Phosphabenzol, Arsabenzol, Stilbabenzol und Bismabenzol)
Autor/Urheber: Roland Mattern, Lizenz: CC BY-SA 3.0
ÜM-Metallkomplexe von Phosphabenzol
Methylphosphorin
synthesis of Triphenylphosphabenzene from Triphenylpyrylium tetrafluoroborate and Tris(hydroxymethyl)phosphine
Struktur des Phosphabenzols
synthesis of Phosphabenzene acc. to Ashe