Phenylalaninhydroxylase
| Phenylalaninhydroxylase | ||
|---|---|---|
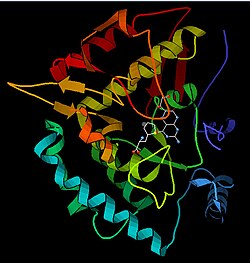 | ||
| nach PDB 1KW0 | ||
Vorhandene Strukturdaten: 1KW0 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 452 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
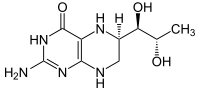
| Kofaktor | Fe2+, Tetrahydrobiopterin | |
| Bezeichner | ||
| Gen-Name | PAH | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.14.16.1, Monooxygenase | |
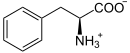
| Substrat | L-Phenylalanin + Tetrahydrobiopterin + O2 | |
| Produkte | L-Tyrosin + 4a-Hydroxytetrahydrobiopterin | |
| Vorkommen | ||
| Homologie-Familie | Phenylalaninhydroxylase | |
| Übergeordnetes Taxon | Lebewesen | |
Die Phenylalaninhydroxylase (PAH) ist dasjenige Enzym, das in allen Lebewesen den Umbau von L-Phenylalanin zu Tyrosin katalysiert. Es ist daher unentbehrlich für alle Eukaryoten, für die hohe Konzentrationen von Phenylalanin im Organismus schädlich sind. PAH ist eisenhaltig, wobei das Eisen nicht an Häm gebunden ist, und bindet Tetrahydrobiopterin als Cofaktor. Dabei wird ein Sauerstoffatom aus einem O2-Molekül für die OH-Gruppe im Tyrosin und das andere im Tetrahydrobiopterin gebunden (s. Mischfunktionelle Monooxygenasen).
Beim Menschen kommt es hauptsächlich in der Zellflüssigkeit (dem Cytosol) von Leberzellen vor. Mutationen am PAH-Gen können zu geringerer bis fehlender Aktivität des Enzyms und entsprechend zu Hyperphenylalaninämie bis hin zur Phenylketonurie führen.[1]
Katalysiertes Reaktionsgleichgewicht
Phenylalanin wird zu Tyrosin oxidiert und umgekehrt Tyrosin zu Phenylalanin reduziert.
Einzelnachweise
Weblinks
- Jennifer McDowall/Interpro: Protein Of The Month: Phenylalanine hydroxylase. (engl.)
Auf dieser Seite verwendete Medien
Struktur von L-Phenylalanin unter physiologischen Bedingungen
I am author, created from PDB 1KW0
Struktur von L-Tyrosin unter physiologischen Bedingungen
Struktur von 4a-Hydroxytetrahydrobiopterin
Struktur von 5,6,7,8-Tetrahydrobiopterin