Perillasäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
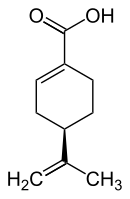 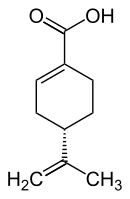 | |||||||||||||||||||
| (+)-Perillasäure (links) bzw. (−)-Perillasäure (rechts) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Perillasäure | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C10H14O2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 166,21 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest[2] | ||||||||||||||||||
| Schmelzpunkt | 132–133 °C[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Perillasäure ist ein Naturstoff. D-(+)-Perillasäure hat antimikrobielle und pilzhemmende („antifungale“) Eigenschaften und ist daher von großem Interesse für die Kosmetik-, Lebensmittel- und pharmazeutische Industrie zur Verwendung als natürliches Konservierungsmittel.
Vorkommen
In der Natur kommt L-(−)-Perillasäure vor allem in der Schwarznessel (Perilla frutescens) vor, wo sie überwiegend als β-Glucosid gebunden ist. Ebenfalls in kleinen Mengen kommt sie in ätherischen Ölen der Schwarznessel und des Zitronengrases vor.
Gewinnung bzw. Darstellung
Die natürlichen Vorkommen zeigen nur eine geringe Konzentration der Perillasäure, daher ist eine Extraktion unwirtschaftlich. Alternativ kann Perillasäure aus β-Pinen synthetisch hergestellt werden, aber auch diese Methode hat relativ geringe Ausbeute und hohe Kosten.
Das gramnegative Bakterium Pseudomonas putida DSM 12264 kann D-(+)-Limonen regioselektiv zur D-(+)-Perillasäure zu oxidieren.[4] Biotechnologisch ist die Herstellung anspruchsvoll, da die Produktion von Perillasäure sowohl von einer zu hohen Konzentration an Limonen als auch von Perillasäure gehemmt wird. Ein 2010 im Labormaßstab weiterentwickelter Bioprozess stellt eine vielversprechende Option für eine industrielle Anwendung dar.[5] Dabei wird das Produkt kontinuierlich durch einen Anionentauscher entfernt und Limonen entsprechend dem Verbrauch zugeführt.
Isomere
Es gibt zwei Enantiomere, die D-(+)-Perrilasäure [auch als (R)-(+)-Perillasäure oder kurz (+)-Perillasäure bezeichnet] sowie die (S)-(−)-Perillasäure [auch als L-(−)-Perillasäure oder kurz (−)-Perillasäure bezeichnet].
Einzelnachweise
- ↑ Eintrag zu PERILLIC ACID in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. August 2020.
- ↑ a b Shmuel Yannai: Dictionary of Food Compounds with CD-ROM: Additives, Flavors, and Ingredients. CRC Press, 2003, ISBN 978-1-4200-6845-0, S. 835 (books.google.de).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Ruben Eckermann: Mit Bakterien gegen Bakterien. In: Nachrichten aus der Chemie. Band 59, 2011, S. 619–620.
Für die biotechnologische Herstellung von Perillasäure verlieh die Arbeitsgemeinschaft industrieller Forschungsvereinigungen „Otto von Guericke“ (AiF) den Otto-von-Guericke-Preis 2011 an Jens Schrader vom Karl-Winnacker-Institut(heute DECHEMA-Forschungsinstitut). - ↑ M. A. Mirata et al.: Integrierte Bioproduktion und selektive Aufreinigung von Perillasäure, Chemie Ingenieur Technik, 82 (2010) S. 101–109.
Auf dieser Seite verwendete Medien
(D)-(+)-Perillasäure; R-(+)-Perillasäure (+)-Perillasäure
(S)-(-)-Perillasäure; L-(–)-Perillasäure; (–)-Perillasäure

