Pentosen
Pentosen (von griech. pente fünf) sind Monosaccharide, deren Kohlenstoffgrundgerüst fünf Kohlenstoffatome enthält.[1] In nicht reduzierter Form haben sie die Summenformel C5H10O5 und unterscheiden sich durch die Art der Carbonylfunktion. Handelt es sich um eine Ketogruppe, so spricht man von Ketopentosen, bei einer Aldehyd-Gruppe nennt man sie Aldopentosen.
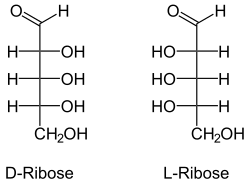
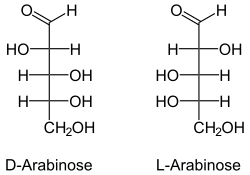
Die Aldopentosen
Die Aldopentosen besitzen drei chirale Zentren, es gibt daher acht Stereoisomere. Von diesen kommen in der Natur nur D-Ribose, D-Xylose, D-Arabinose und L-Arabinose vor. D- und L-Lyxose kommt in der Natur nicht in freier Form vor. Die D/L-Konfiguration bezieht sich bei den Aldopentosen stets auf die Position der OH-Gruppe am 4. C-Atom und hat keinen Bezug zur Drehrichtung der optischen Aktivität.
- Aldopentosen in Fischer-Projektion
Durch eine intramolekulare Halbacetal-Bildung stehen diese offenkettigen Moleküle im Gleichgewicht mit ihren Pyranose- bzw. Furanose-Formen. Dabei kommt es zur Sauerstoffbrücke zwischen dem 1. und dem 5. C-Atom (Pyranose) bzw. dem 1. und 4. C-Atom (Furanose), und das Sauerstoffatom der Aldehydgruppe wird zur Hydroxygruppe.
Die Ketopentosen
Die Ketopentosen (synonym Pentulosen) besitzen zwei chirale Zentren, es gibt daher vier Stereoisomere. Die D/L-Konfiguration bezieht sich – wie oben – auf die Position der OH-Gruppe im vierten C-Atom, und hat keinen Bezug auf das Vorzeichen [(+) oder (−)] des Drehwertes α. In der Natur kommen nur die zwei D-Isomere vor.
- Ketopentosen in Fischer-Projektion
Pentosen und ihre biologische Bedeutung
Die D-Ribose und ihre reduzierte Form die D-Desoxyribose sind wesentliche Bestandteile der RNA bzw. der DNA.
Die D-Ribulose dient als CO2-Akzeptor bei der Photosynthese.
Der Stoffwechsel von Pentosen und ihre Bildung durch Decarboxylierung von Hexosen ist im Pentosephosphat-Zyklus zusammengefasst. Schlüsselreaktion ist die direkte Oxidation des Glucose-6-phosphats durch das Enzym Glucose-6-phosphat-Dehydrogenase, dessen Gen beim Menschen auf dem X-Chromosom liegt. Defekte können eine Reihe von Krankheitsbildern (z. B. in der Blutbildung) und Überreaktionen auf bestimmte Medikamente hervorrufen.
Siehe auch
Einzelnachweise
- ↑ Paula Y. Bruice: Organische Chemie. 5., aktualisierte Auflage. Pearson Studium, München u. a. 2007, ISBN 978-3-8273-7190-4, S. 1118–1119.
Weblinks
Auf dieser Seite verwendete Medien
Struktur von Xylose
Struktur von Ribose
Struktur von Ribulose
Struktur von Arabinose
Struktur von Xylulose
Struktur von Lyxose