Partialladung

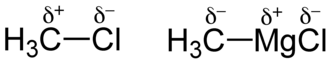
Unter Partialladung (lat. pars „Teil“, daher auch Teilladung), auch partielle Ladung, versteht man die unterschiedliche Ladung zweier Bindungspartner (Atome oder Molekülteile). Sie treten durch polare Atombindungen auf.[1] Die Ladungen werden in chemischen Formeln mit δ− und δ+ oberhalb des Elementsymbols gekennzeichnet.[1]
Unterscheiden sich die Bindungspartner einer Atombindung in ihrer Elektronegativität, so ist die Verteilung der Bindungselektronen nicht mehr gleichmäßig, sondern es kommt zu einer Polarisation (unterschiedliche Ladung der Partner), die durch die Verschiebung der Ladungsträger (Elektronen) hervorgerufen wird. Diese Elektronenverschiebung bewirkt, dass die Bindungspartner teilweise (= partiell) positiv und negativ geladen sind.[1] Die Partialladung in einer XY-Bindung kann mit folgender Formel abgeschätzt werden:
Dabei steht für die Gruppennummer des Elements , ist die Anzahl der nicht an der Bindung beteiligten Elektronen vom Atom , ist die Anzahl der Elektronen, welche an der Bindung beteiligt sind und bzw. sind die Elektronegativitätswerte von bzw. . So erhält man zum Beispiel für das Molekül HF: und , F ist also partial negativ und H partial positiv geladen.[2]
Oder in anderen Worten: Der errechnete Wert steht dabei für den prozentualen Anteil der Entfernung zwischen Atomkern des Elements und Atomkern des Elements . In diesem Fall ist das Elektronenpaar zwischen Fluor und Wasserstoff zu ca. 64,5 % vom Wasserstoff- und zu 35,5 % vom Fluor-Atom entfernt. Somit ist das Elektronenpaar näher am Fluor-Atom, weswegen es eine negative Partialladung erhält.
Dabei muss gelten: mit
Je größer die Elektronegativitätsdifferenz (ΔEN) ist, desto größer wird der Grad der Polarisation und damit die Ausbildung der Partialladungen. Da zwischen unterschiedlichen Ladungen Bindungskräfte entstehen, werden diese umso größer, je größer der Ladungsunterschied ist. Ab einer bestimmten Größe der Differenz spricht man von einer Ionenbindung und Ionen.
Einzelnachweise
Auf dieser Seite verwendete Medien
Autor/Urheber: Jü, Lizenz: CC0
Wasser. Molekül mit Partialladungen Delta-Plus und Delta-Minus.
Polarität und Umpolung

