Histologische Technik
Histologische Technik (von gr. histos „Gewebe“) oder kurz Histotechnik ist in der Histologie ein Sammelbegriff für die Verfahren der Gewebeaufbereitung für die mikroskopische Untersuchung. Die Entwicklung dieser Verfahren hat vom Ende des 19. bis Mitte des 20. Jahrhunderts eine bedeutende Rolle in der medizinischen Forschung und Wissenschaft gespielt, besonders in der Anatomie und Pathologie, aber auch in der Mikrobiologie. Sie war dabei von der Vervollkommnung des analogen Lichtmikroskops begleitet.

1 Glasobjektträger (76 × 26 mm), 2 Deckglas,
3 gefärbter Organschnitt
Geschichte

Zu Beginn der mikroskopischen Naturforschung wurden kleine Objekte, etwa Froscheier oder Rasiermesserschnitte von Objekten untersucht. Hooke prägte 1665 den Begriff „Zelle“ nach Untersuchung von Korkschnitten. Weitere Pioniere waren Malpighi (1628–1694), Huygens (1629–1695), van Leeuwenhoek (1632–1723). Die damals verwendeten Optiken mit kleiner Apertur ergaben zwar kontrastreiche Bilder, aber bei geringer Auflösung. Noch Schleiden (1804–1881) und Schwann (1810–1882), die Begründer der Zellenlehre, arbeiteten mit ungefärbten Präparaten.
Gegen Ende des 19. Jahrhunderts setzten Versuche ein, Zell- und Gewebestrukturen färberisch darzustellen – mit Höhepunkt im ersten Drittel des 20. Jahrhunderts. Das Ende dieser Entwicklung der histologischen Technik wurde durch die Einführung der Elektronenmikroskopie in die Zell- und Gewebeforschung ab Mitte des 20. Jahrhunderts herbeigeführt. Um diese Zeit wurden auch für die Lichtmikroskopie spezifische Nachweisverfahren, wie die Histochemie, Immunhistochemie oder Ultraviolett-Mikrospektrophotometrie[2][3] entwickelt.
Präparationsmethodik für die Lichtmikroskopie
Voraussetzung für die lichtmikroskopische Untersuchung im Durchlicht sind dünne, lichtdurchlässige Schnitte einer Organprobe (Gewebeschnitt). Nur in wenigen Fällen lässt sich auf Schnitte verzichten: Blutausstrich, Schleimhautabstrich, Zellkultur, Quetschpräparat. Für das meist übliche Hellfeldverfahren ist es außerdem notwendig, die Präparate zu färben, weil die Gewebestrukturen bis auf wenige Ausnahmen kaum Eigenfarbe besitzen. Die meist verwendete Verarbeitungsmethode von medizinischen Proben ist die Paraffineinbettung nach Formaldehyd-Fixierung (FFPE-Gewebe).[4] Daneben gibt es viele Spezialmethoden der Fixierung und Einbettung, die in Abhängigkeit vom Untersuchungsmaterial, gewünschter Schnittdicke und Untersuchungsziel gewählt werden können.
Fixierung
Die Fixierung stoppt die Lebensvorgänge von Zellen und Geweben durch Denaturierung der Proteine. Die dazu verwendeten Eiweißfällungsmittel verhindern Strukturveränderungen durch Autolyse, Substanzverluste bei der weiteren Behandlung sowie postmortale Strukturverschiebungen. Geeignete Fixantien sind verschiedene Aldehyde (z. B. Formaldehyd), Schwermetallverbindungen (z. B. Sublimat), organische Säuren (z. B. Essigsäure, Pikrinsäure) und Alkohole (Ethanol, Methanol). Sie denaturieren die Proteine durch chemische Bindungen oder Entfaltung von Aminosäureketten. Dadurch werden Strukturen stabilisiert und enzymatische Aktivitäten ausgeschaltet. Für eine schnelle Durchtränkung und damit möglichst lebensnahe Erhaltung sollte die Kantenlänge der Gewebeprobe 1 cm nicht wesentlich überschreiten. Eine weitere Möglichkeit der möglichst lebensnahen Fixierung ist die Perfusionsfixierung, das heißt Spülung mit Fixierlösung durch die Blutgefäße. Die zum Fixieren verwendeten Chemikalien werden anschließend durch eine Wässerung ausgewaschen.
Die Paraffineinbettung
Für die mikroskopische Untersuchung sind durchstrahlbare Präparate notwendig. Die Härtung des Gewebes durch die Fixierung reicht nicht für die Herstellung genügend dünner Schnitte aus. Es ist eine Einbettung in schneidbare Substanzen notwendig: meistens Paraffin, für manche Zwecke Kunststoffe. Das in den Geweben reichlich vorhandene Wasser wird dabei durch das Einbettungsmedium ersetzt. Da sich Wasser jedoch mit geschmolzenem Paraffin nicht mischt, muss der Austausch über Zwischenmedien erfolgen. Vorgehen im Einzelnen:
- Zuschnitt/makroskopische Begutachtung: Relevante Areale werden aus größeren Proben in einer verarbeitbaren Größe zurechtgeschnitten (z. B. 20 × 20 × 3 mm).
- Entwässerung: Das Gewebe wird sukzessive mit Alkohol in steigender Konzentration durchtränkt (aufsteigende Alkoholreihe).
- Intermedium: Nach der Entwässerung muss das Gewebe mit einem Reagenz, das sich sowohl mit Alkohol als auch mit Paraffin gleichermaßen mischt, durchtränkt werden. Dazu wird zumeist Xylol eingesetzt.
- Einbettung/Infiltration: Das Gewebe wird mit erwärmtem, verflüssigtem Paraffin durchtränkt. Zuvor wassergefüllte Räume sind nun vom Einbettmedium eingenommen.
- Ausgießen/Einblocken: Der Histotechniker stellt kleine Paraffinquader her, die das Gewebe beinhalten. Dazu lässt man das vorerst heiße Paraffin erkalten und erstarren. Damit erhält es die notwendige Festigkeit, um an Spezialgeräten dünne Schnitte herstellen zu können.
Andere Einbettmedien wie Kunststoffpolymere, Gelatine, Agar oder Nitrocellulose verlangen eine andere Vor- und Nachbehandlung. Von in Kunststoff eingebettetem Gewebe können für die Lichtmikroskopie Dünn- und Semidünnschnitte sowie für die Elektronenmikroskopie Ultradünnschnitten hergestellt werden.
Schneiden
Die Herstellung der meist unter 10 µm dicken (Paraffin-)Schnitte erfolgt mit dem Mikrotom. Die Schnitte werden auf Glasobjektträger aufgezogen. Zur Untersuchung werden meist mehrere Schnitte hergestellt, um relevante Strukturen sicher zu erfassen (Schnittserie oder Serienschnitte).
Gefrierschneiden, Schnellschnitte
Für manche Zwecke, z. B. Schnelldiagnosen bei Operationen, histochemische Untersuchungen oder Erhaltung von Fetten, ist eine Einbettung nicht anwendbar (Fette werden bei Paraffineinbettung durch die organischen Lösungsmittel herausgelöst). In diesen Fällen kann man das Gewebe frieren und dann sogenannte Gefrier- oder Schnellschnitte herstellen. Wenn es der Untersuchungszweck zulässt, ist eine vorherige Fixierung empfehlenswert. Die Qualität von Gefrierschnitten erreicht im Allgemeinen nicht die von Paraffinschnitten.
Färben


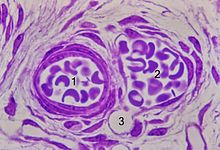
kleine Blutgefäße, Kunststoffschnitt.
Arteriole (1), Venole (2) mit einmündender Kapillare (3)
Um den notwendigen Kontrast für eine Beurteilung im Mikroskop zu erreichen, behandelt man die Schnittpräparate mit verschiedenen Farbstoffen. Nur gelegentlich wird die Gewebeprobe schon im Stück, vor dem Schneiden gefärbt. Da die meisten Farblösungen wässrig sind, wird das Paraffin mit Xylol, nachfolgend Alkohol und Wasser aus den Schnittpräparaten entfernt.
Es gibt eine Vielzahl an Färberezepten. Für Übersichtsdarstellungen hat sich die Kombination eines basischen mit einem sauren Farbstoff bewährt.[5] Die Farb- bzw. Reaktionslösungen sind meist wässrig, daher werden die Präparate zur Herstellung eines optisch homogenen Dauerpräparates wieder über Alkohol, Xylol oder Isoparaffine entwässert und mit Hilfe eines synthetischen Eindeckmediums auf dem Objektträger mit einem Deckglas „eingedeckt“. Vorausgesetzt es sind keine Säurereste von der Färbung im Gewebeschnitt, sind solchermaßen hergestellte Präparate mehrere Jahrzehnte haltbar. Bei der alternativen Verwendung eines mit einem passenden Medium beschichteten Klebefilmes sind die Haltbarkeit und optische Qualität weniger gut.
Blutausstriche werden meist nach Pappenheim, Schleimhautabstriche nach Papanicolaou gefärbt. Bei diesen Methoden werden zur Darstellung zytologischer Details mehrere Farbstoffe angewandt. Bei Kunststoffschnitten ist die Färbbarkeit in der Regel auf einen Farbstoff beschränkt. Doch ergibt sich wegen der geringen Dicke (0,5–2 μm) eine gute Auflösung im mikroskopischen Bild.
Injektionspräparate
Zur Darstellung von Blutgefäßen, insbesondere des Kapillarnetzes, können Injektionspräparate mit Tusche oder gefärbter Gelatine angefertigt werden. Dabei werden diese Lösungen vor der Gewebsfixierung in das Blutgefäßsystem gespritzt. Nach Fixierung und Paraffineinbettung stellt man etwas dickere Schnitte her und kann so im Mikroskop den Gefäßverlauf verfolgen.
Präparationsmethodik für die Transmissionselektronenmikroskopie
In einem Transmissionselektronenmikroskop durchstrahlen Elektronen das Objekt. Die Gewebeproben werden für die Transmissionselektronenmikroskopie in prinzipiell gleicher Weise präpariert wie für die Lichtmikroskopie.
Fixierung
Das bis an die Molekülstruktur reichende Auflösungsvermögen des Elektronenmikroskops macht eine optimale Strukturerhaltung notwendig. Die Kantenlänge der Proben sollte unter 3 mm betragen; wenn möglich ist eine Perfusionsfixierung (s. o.) durchzuführen. Als Fixative haben sich Lösungen von Glutaraldehyd und Osmiumtetroxid bewährt.
Einbettung
Nach Entwässerung der Proben in Alkohol oder Aceton erfolgt die Einbettung in Kunststoffe, z. B. einem Epoxidharz.
Schneiden (Ultramikrotomie)
Die von den Gewebeproben hergestellten Kunststoffblöcke werden mit einem Ultramikrotom geschnitten. Verwendet werden Glas- oder Diamantmesser. Benötigt werden Schnittdicken zwischen 50 und 100 nm. Als Objektträger dienen kleine Kupfernetze, welche die elektrische Aufladung durch den Elektronenstrahl ableiten.
Kontrastieren
Zur Kontraststeigerung der Zell- und Gewebestrukturen werden die Dünnschnitte meist mit Uran- und Bleiverbindungen behandelt. Dieses Kontrastieren entspricht dem Färben für die Lichtmikroskopie.
Kontaktradiografie
Die Kontaktradiografie ist eine Technik zur feingeweblichen Untersuchung von Knochen.[6] Dabei wird ein Röntgenbild eines Dünnschliffpräparats hergestellt und analysiert.[6] Sie wird zum Beispiel verwendet, um die Wirkung von Knochenimplantaten auf Knochengewebe zu untersuchen.[6]
Literatur
- Gudrun Lang: Histotechnik. 2006, Springer-Wien-New York, ISBN 3-211-33141-7
- Benno Romeis: Mikroskopische Technik, 16. Auflage 1968, Verlag R. Oldenbourg, München-Wien.
- Leopold Voss: Histotechnik der leprösen Haut, 1910, Hamburg
Einzelnachweise
- ↑ Matthias Jacob Schleiden: Die Pflanze und ihr Leben. Engelmann, Leipzig 1848
- ↑ T. Casperson: Über den chemischen Aufbau der Strukturen des Zellkernes. Scand. Archiv f. Physiol. 73, Suppl. 8, S. 1–151, 1936, zit. nach Romeis
- ↑ Benno Romeis: Mikroskopische Technik, 16. Auflage, Verlag R. Oldenbourg München-Wien 1968
- ↑ Tim D. Hewitson, Ian A. Darby: Histology Protocols. In: Methods in molecular biology. Band 611, 2009. doi:10.1007/978-1-60327-345-9.
- ↑ Benno Romeis: Mikroskopische Technik, 16. Auflage, Verlag R. Oldenbourg, München-Wien 1968
- ↑ a b c Gudrun Lang (Hrsg.): Histotechnik – Praxislehrbuch für die biomedizinische Analytik. 2., überarbeitete und aktualisierte Auflage. Springer, Wien/New York 2012, ISBN 978-3-7091-1189-5.
Auf dieser Seite verwendete Medien
Autor/Urheber: Rollroboter, Lizenz: CC BY-SA 3.0
Lichtmikroskopisches Schnittbild kleiner Blutgefäße. 1 Arteriole, 2 Venole mit einmündender Kapillare 3. Kunststoff- Einbettung, Kresylviolett-Färbung
Autor/Urheber: Rollroboter, Lizenz: CC BY-SA 3.0
Schnittpräparat für die Lichtmikroskopie. 1 Glasobjektträger (76 x 26 mm), 2 Deckglas, dazwischen 3 gefärbter Organschnitt
Autor/Urheber: Rollroboter, Lizenz: CC BY-SA 3.0
Glattes Muskelgewebe im lichtmikroskopischen Längsschnitt (Masson/Goldner-Färbung)
Autor/Urheber: Rollroboter, Lizenz: CC BY-SA 3.0
Modifizierte Azanfärbung: Kollagenes Bindegewebe blau. Nebenhoden
Autor/Urheber: Rollroboter, Lizenz: CC BY-SA 3.0
Lichtmikroskopisches Längsschnittbild quergestreifter Muskelfasern (Hämatoxylin-Eosin-Färbung)





