Oxidative Phosphorylierung
| Übergeordnet |
| Energiestoffwechsel Phosphorylierung |
| Untergeordnet |
| Atmungskette Chemiosmosis |
| Gene Ontology |
|---|
| QuickGO |
Die oxidative Phosphorylierung ist ein biologischer Prozess, der in allen aeroben Lebewesen stattfindet. Sie ist Teil des Energiestoffwechsels und dient der Energiegewinnung in Form von ATP. Die zur Herstellung von ATP benötigte Energie wird dabei mittels der Atmungskette gewonnen und mithilfe der chemiosmotischen Kopplung in chemische Energie umgesetzt. Beteiligt sind außerdem noch Transportproteine.
Beteiligte Enzyme
Atmungskette

Komplex V
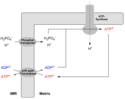
Der Komplex V, der schließlich ATP synthetisiert, besteht aus zwei Teilen: Der F1-Teil ragt in die Matrix des Mitochondriums hinein, während der Fo-Teil einen Protonen-Kanal durch die innere Mitochondrienmembran bildet. Mit Hilfe der vorangeschalteten vier Komplexe der Atmungskette wurde ein Protonengradient und somit ein elektro-chemisches Potenzial ΔP aufgebaut, indem H+-Ionen nach außen in den Intermembranraum gepumpt werden, und zwar gegen die dort positive Spannung ΔΨ und die dort höhere Protonenkonzentration ΔpH. So entsteht Triebkraft der Protonen zur Matrix des Mitochondriums hin. Den passenden Kanal stellt die Fo-Untereinheit dar. Vergleichbar mit einer Turbine – und tatsächlich konnte eine Rotation des Fo-Teils nachgewiesen werden – wird durch den Protonenfluss Energie freigesetzt, die zur Synthese von ATP durch die F1-Untereinheit verwendet wird (siehe Mechanismus der ATP-Synthase).
Strittig ist noch die Frage, wie viele Protonen für die Synthese eines ATP Moleküls aus ADP und anorganischem Phosphat benötigt werden. Nach Löffler, Petrides:[1] mindestens 3, wobei bei der Bilanzierung ein weiteres Proton (also insgesamt mindestens 4) auftaucht, das für den Transport von Phosphat (durch Phosphat/H+-Symport) in den Matrixraum benötigt wurde.
Je nachdem, aus wie vielen c-Untereinheiten der Transmembranring (Fo c-Ring) besteht, müssen unterschiedlich viele Protonen durch Fo in die Matrix transportiert werden. Es können 10–14 Untereinheiten sein. F1 bildet pro 120° Drehung der Gamma-Einheit 1 Molekül ATP – also bei einer ganzen Umdrehung (360°) 3 Moleküle ATP. Für die Bildung eines ATP-Moleküls durch die ATP-Synthase aus E. coli bzw. Chloroplasten werden 4 Protonen benötigt.[2]
Transportproteine
ATP/ADP-Translokase

Das durch Komplex V erzeugte ATP kann die innere Mitochondriummembran nicht frei passieren. Umgekehrt kann das für die ATP-Synthase benötigte ADP nicht aus dem Cytosol in die Matrix diffundieren. Jedoch existiert ein spezielles Transportsystem, um ATP in das Cytosol und ADP in die Matrix zu bringen, die so genannte ATP/ADP-Translokase (siehe dort).
Die Translokase ist ein häufiges Protein der inneren Membran des Mitochondriums und kann bis zu 14 % aller Proteine der inneren Membran ausmachen.[3] Infolgedessen ist es unwahrscheinlich, dass die ATP-Synthese aus Mangel an ADP limitiert ist.
Phosphattransporter
Für die Synthese von ATP aus ADP wird auch Phosphat benötigt. Dieses kann ebenso wenig durch die innere Membran des Mitochondriums diffundieren wie ATP und ADP selbst. Der Transport wird durch einen speziellen Symporter, den mitochondriellen Phosphat-Transporter ermöglicht, der gleichzeitig ein Proton und ein Phosphatmolekül aus dem Intermembranraum in die Matrix transportiert. Dessen Aktivität kann durch Mersalyl inhibiert werden.
Einzelnachweise
- ↑ Georg Löffler, Petro E. Petrides: Biochemie und Pathobiochemie. Springer-Verlag, Berlin; 8. Auflage 2007; ISBN 978-3-540-32680-9; Wikibooks.
- ↑ Stefan Steigmiller, Paola Turina, Peter Gräber: The thermodynamic H+/ATP ratios of the H+-ATPsynthases from chloroplasts and Escherichia coli. In: Proceedings of the National Academy of Sciences. 105. Jahrgang, Nr. 10, 2008, S. 3745–3750 (pnas.org).
- ↑ Thomas M. Devlin (Hrsg.): Textbook of Biochemistry with Clinical Correlations. Wiley & Sons; 6. Auflage 2005; ISBN 0-471-67808-2; S. 570.
Auf dieser Seite verwendete Medien
ADP ATP Shuttlesystem (Version 1)
Schematische Darstellung der mitochondrialen Elektronentransportkette (Atmungskette).