Nitrosamine
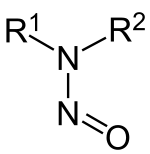
Nitrosamine, genauer N-Nitrosamine, sind eine Stoffklasse organisch-chemischer Verbindungen, die sich von sekundären Aminen ableitet. Es handelt sich um Salpetrigsäureamide, also Säureamide der Salpetrigen Säure.[1] Sie haben die allgemeine Strukturformel R1R2N-NO; dabei sind R1 und R2 Alkyl- oder Aryl-Reste. Nitrosamine wirken karzinogen und haben keine großtechnische Bedeutung. Sie kommen ubiquitär vor.
Eigenschaften
Unter Standardbedingungen sind Nitrosamine meist flüssig oder fest. Wegen der hydrophilen N–N=O-Gruppierung sind sie in Wasser und anderen polaren Lösungsmitteln löslich. Die Dichte variiert zwischen 0,9 und 1,2 g pro cm³.[2]
Sind R1 und R2 Organylreste (Alkylreste, Arylreste etc.), sind die Nitrosamine stabiler, als wenn R1 oder R2 für ein Wasserstoffatom steht.
Entstehung
Nitrosamine entstehen aus sekundären Aminen durch Einwirkung von nitrosierenden Agentien (z. B. salpetrige Säure und deren Salze, die Nitrite, Stickstoffoxide). Nitrosamine werden im sauren Milieu gebildet, wie es etwa auch endogen im menschlichen Magen herrscht. Dabei bildet sich aus Nitrit zunächst HNO2. Diese spaltet sich nach erneuter Protonierung in ein Nitrosyl-Kation (NO+) und Wasser auf [siehe (1)]. Das Nitrosyl-Kation reagiert mit dem Amin zum Nitrosamin weiter [siehe (2)]. Andererseits können Nitrosamine auch endogen durch körpereigene Bakterien gebildet werden.[2]
- (1)
- (2)
In der Atmosphäre bilden sich Nitrosamine auch photochemisch aus geeigneten Aminen durch Einwirkung von Stickstoffoxiden. Die unvollständige Verbrennung stickstoffreicher Materialien kann ebenfalls zur Bildung von Nitrosaminen führen.
Vorkommen
Hinweise für das Vorliegen von Nitrosaminen in Lebensmitteln pflanzlicher Herkunft, in Böden oder im Grundwasser gibt es nicht, jedoch können die darin enthaltenen Nitrate durch Zubereitung dennoch Nitrosamine bilden. Nitrosamine kommen – typischerweise in sehr geringen Dosen – in vielen Lebensmitteln vor, beispielsweise in Bier, Fischen, gepökelten Fleischerzeugnissen oder in Käse. N-Nitrosamine sind Reaktionsprodukte von Nitrit und sekundären Aminen (wie in Proteinen), die vor allem unter Hitzeeinwirkung gebildet werden. Beim Erhitzen gepökelter Lebensmittel sowie beim Wiederaufwärmen von Spinat, dessen intrazelluläre Nitratdepots mikrobiell zu Nitrit umgewandelt wurden, besteht ebenfalls die Gefahr der Nitrosaminbildung.
Nitrosamine lassen sich auch in Latex-Matratzen, Luftballons, Kondomen, in einigen Arzneistoffen (wie Atenolol, Rifampicin, Valsartan) sowie in Tabak nachweisen. In Kinderspielzeug aus Natur- und Synthesekautschuk, das in dem Mund genommen wird, gilt das ALARA-Prinzip. Hersteller können durch Auswahl geeigneter Vulkanisationsbeschleuniger die Entstehung kanzerogener N-Nitrosamine weitestgehend vermeiden.[3]
Ein folgenreiches Beispiel für das unerwünschte Vorkommen von Nitrosaminen zeigt sich am alten Hauptsitz der Continental AG in Hannover-Limmer. Dort stehen heute noch zwei Abschnitte eines alten Gebäudekomplexes unter Denkmalschutz, die auf Grund von mit Nitrosaminen kontaminierten Wänden seinerzeit aufgegeben werden mussten und noch nicht saniert wurden. Auch eine Nutzung des alten Betriebsgeländes war bis vor kurzem nicht möglich. Erst nach aufwändiger Sanierung und Aushub des Bodens kann dort jetzt neuer Wohnraum entstehen. Die beiden mit Nitrosaminen belasteten Gebäudeteile stehen nach wie vor unter Denkmalschutz, jedoch ist ein Betreten des Geländes aus gesundheitlichen Gründen untersagt.[4]
Nitrosamine können auch in wasserhaltigen Kühlschmiermitteln – aus in Nitrit umgewandeltem Nitrat des Ansetzwassers und eingeschleppten Aminen (Lebensmittelreste, Zigaretten) – entstehen. Leitkomponente ist N (NDELA), (HOC2H4)2N–NO.
Der Gehalt von N-Nitrosodiethanolamin in wasserhaltigen Kühlschmierstoffen kann mittels Gaschromatographieverfahren mit TEA-Detektorsystem (Thermal Energy Analyzer) analytisch bestimmt werden.[5] Gleiches gilt für die Bestimmung von N (NMOR) in wässrigen Lösungen und wassergemischten Kühlschmierstoffen.[6]
Auswirkungen auf die Gesundheit
Im Tierversuch wurde in sämtlichen Spezies eine stark krebserzeugende Wirkung bei 90 % der untersuchten Nitrosamine nachgewiesen. Nitrosamine sind Präkanzerogene, das heißt, sie müssen im Körper aktiviert werden, damit sie ihre schädliche Wirkung entfalten können. Dies erfolgt durch eine Cytochrom-P450-katalysierte Reaktion. In nachfolgenden Reaktionen werden das sehr reaktive Formaldehyd sowie Carbeniumionen freigesetzt, die eine stark gentoxische Wirkung haben.[7]
Epidemiologische Studien deuten auf eine positive Korrelation zwischen Nitrit- und Nitrosaminaufnahme und Magenkarzinom sowie zwischen dem Verzehr von Fleisch- und Wurstwaren und Magen- und Speiseröhrenkrebs hin.[8]
Weitere epidemiologische Studien sehen zudem eine Korrelation zwischen dem zunehmenden Einsatz von Nitrat und Nitrit in Landwirtschaft (Düngung) und Nahrungsmittelindustrie (Konservierungsmittel), der dadurch erhöhten Belastung mit Nitrosaminen und der steigenden Zahl von Alzheimer-, Parkinson- und Diabetesfällen.[9]
Nitrosamine haben im Tierversuch auch Schäden der Leber und des Erbgutes hervorgerufen.[10]
Nitrosodialkylamine (R1, R2 = Alkylrest) werden im Körper zu Alkyldiazohydroxiden metabolisiert, welche die ultimalen Kanzerogene darstellen, also die eigentlich krebserzeugende Wirkung haben. Diese zerfallen unter Stickstoffabgabe zu hochreaktiven Carbeniumionen, welche Addukte mit DNA, RNA und Proteinen bilden können. N-Nitrosodimethylamin beispielsweise methyliert die DNA-Basen Guanin und Adenin.
Nachweis
Nachgewiesen werden Nitrosamine unter anderem durch einen Chemilumineszenz-Detektor oder mittels hochauflösender Massenspektrometrie, jeweils nach Trennung durch Gaschromatographie.[2]
Literatur
- Ahmed Askar: Amine und Nitrosamine – Vorkommen, Bedeutung, Stoffwechsel und Bestimmung. 2. unveränderte Auflage. Technische Universität Berlin, Institut für Lebensmitteltechnologie, Berlin 1979, ISBN 3-7983-0204-9.
- G. Eisenbrand, M. Metzler: Toxikologie für Chemiker. Georg Thieme Verlag, Stuttgart 1994, ISBN 3-13-127001-2, S. 66.
Nachweise
- ↑ Norman L. Allinger, Michael P. Cava, Don C. de Jongh, Carl R. Johnson, Norman A. Lebel, Calvin L. Stevens, Michael P. Cava: Organische Chemie. De Gruyter, 2011, ISBN 978-3-11-082970-9, Kapitel 10. Funktionelle Gruppen mit mehrfach gebundenen Heteroatomen, S. 340, doi:10.1515/9783110829709.336.
- ↑ a b c Eintrag zu Nitrosamine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juli 2014.
- ↑ Spielzeug aus Natur- und Synthesekautschuk für Kinder unter drei Jahren: Freisetzung von N-Nitrosaminen sollte so gering wie möglich sein, Stellungnahme Nr. 005/2012 des BfR vom 17. Januar 2011.
- ↑ haz.de: Papenburg darf Conti-Gebäude auf Wasserstadtareal nicht abreißen, 10. Dezember 2019.
- ↑ Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA): Messverfahren zur Bestimmung von N-Nitrosodiethanolamin (NDELA) in wassergemischten Kühlschmierstoffen. Abgerufen am 20. Januar 2022.
- ↑ Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung (IFA): Bestimmung von N-Nitrosomorpholin in wässrigen Lösungen und wassergemischten Kühlschmierstoffen. Abgerufen am 20. Januar 2022.
- ↑ Sharma Veena, Singh Rashmi: A Review on Mechanism of Nitrosamine Formation, Metabolism and Toxicity in In Vivo. Abgerufen am 24. Dezember 2016 (englisch).
- ↑ P. Jakszyn, C. A. Gonzalez: Nitrosamine and related food intake and gastric and oesophageal cancer risk: a systematic review of the epidemiological evidence. World J Gastroenterol. 2006 Jul 21; 12(27), S. 4296–4303, PMID 16865769.
- ↑ Suzanne M. De la Monte, Alexander Neusner, Jennifer Chu, Margot Lawton: Epidemilogical Trends Strongly Suggest Exposures as Etiologic Agents in the Pathogenesis of Sporadic Alzheimer's Disease, Diabetes Mellitus, and Non-Alcoholic Steatohepatitis. In: Journal of Alzheimer's Disease. 17:3 (July 2009), S. 519–529, PMID 19363256.
- ↑ zusatzstoffe-online.de: Natriumnitrit.
