Nitrendipin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Vereinfachte Strukturformel ohne Angabe der Konfiguration – 1:1-Gemisch (Racemat) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Nitrendipin | |||||||||||||||||||||
| Andere Namen | (RS)-Ethyl-5-(methoxycarbonyl)-2,6-dimethyl-4-(3-nitrophenyl)-1,4-dihydropyridin-3-carboxylat (IUPAC) | |||||||||||||||||||||
| Summenformel | C18H20N2O6 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | C08CA08 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 360,36 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | sehr schwer in Wasser (77,2 mg·l−1 bei 25 °C)[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Nitrendipin ist ein Arzneistoff aus der Gruppe der Calciumantagonisten vom 1,4-Dihydropyridin-Typ. Es senkt über eine Erweiterung der glatten Muskulatur der Gefäße den Blutdruck stark. Therapeutisch wird es eingesetzt zur Behandlung der arteriellen Hypertonie.
Stereochemie
Die Moleküle von Nitrendipin enthalten ein Stereozentrum (Chiralitätszentrum). Daher gibt es zwei Enantiomere. Aufgrund der Synthese wird ein Racemat, also ein 1:1-Gemisch von (R)- und der (S)-Form gebildet.[4]
| Enantiomere von Nitrendipin | |
|---|---|
 (R)-Nitrendipin |  (S)-Nitrendipin |
Erfindung
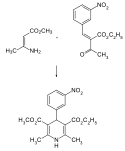
Das Konstitutionsisomer von Nifedipin – mit der Nitrogruppe in 3-Stellung – wurde in den Laboratorien der Firma Bayer AG von Horst Meyer und Friedrich Bossert nach dem Prinzip der Hantzsch-Synthese hergestellt. Das Dihydropyridin wurde aus zwei Molekülbausteinen durch Addition und intramolekulare Kondensation (Cyclisierung) aufgebaut. Aus 3-Nitrobenzaldehyd wurde durch intermolekulare Kondensation mit Acetessigsäureethylester 3'-Nitrobenzyliden-acetessigsäure-ethylester erhalten. Dieser wurde mit dem zweiten Baustein – 3-Amino-2-butensäuremethylester (β-Aminocrotonsäuremethylester) – umgesetzt.[5] So wurde ein 1,4-Dihydropyridin mit ungleichen Carbonsäureestergruppen erhalten.
Wirkmechanismus
Nitrendipin blockiert den Calcium-Einstrom in die Herzmuskelzellen, die glatte Muskulatur und in das Erregungsbildungs- und Leitungssystem des Herzens. Dies führt am Herz zu einer herabgesetzten Kontraktilität (negativ inotrop) und einem reduzierten O2-Verbrauch. An der glatten Muskulatur bewirkt es eine Erweiterung der kleinen Arterien (Arteriolen) und damit eine Nachlastsenkung. Nitrendipin ist ein Dihydropyridin. Unter therapeutischen Dosen liegt die Wirkung von Nitrendipin und anderen Dihydropyridin-Calciumantagonisten kaum am Herzen, sondern fast ausschließlich an Gefäßen.
Indikationen
Nitrendipin ist in Deutschland zugelassen zur Therapie der essentiellen arteriellen Hypertonie und als Bayotensin® akut zur Behandlung des hypertensiven Notfalls.
Nebenwirkungen
Häufig kommt es zum Auftreten von Unterschenkelödemen, Kopfschmerzen sowie Flush, sowie gelegentlich zu Schwindel, Müdigkeit und Hypästhesien.
Seltene Nebenwirkungen sind Tachykardie, Palpitation, Übelkeit, Völlegefühl, Durchfall und vermehrter Harndrang.
Kontraindikationen
Bei kardiogenem Schock, instabiler Angina Pectoris, Herzinfarkt (innerhalb der ersten 4 Wochen) und Kindern (keine ausreichenden Erfahrungen) ist die Gabe von Nitrendipin kontraindiziert.
Handelsnamen
Bayotensin (D), Baypress (A, CH), Jutapress (D), zahlreiche Generika (D). Der Vertrieb von Bayotensin® akut zur Behandlung der hypertensiven Krise wird ab Mitte 2021 aus „produktionstechnischen Gründen“ eingestellt. Die Kunststoffphiolen sind nicht mehr verfügbar.[6]
Baroprine (A), Cenipres (A), Eneas (D)
Literatur
- Friedrich Bossert, Horst Meyer, Egbert Wehinger: 4-Aryldihydropyridine, eine neue Klasse hochwirksamer Calcium-Antagonisten. In: Angewandte Chemie, 93, 1981, S. 755, doi:10.1002/ange.19810930906; Angewandte Chemie International Edition in English. 20, 1981, S. 762, doi:10.1002/anie.198107621.
- The Merck Index, 11. Auflage, 1989, S. 1040, Eintrag Nr. 6493.
Einzelnachweise
- ↑ Eintrag zu Nitrendipin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- ↑ a b Eintrag zu Nitrendipine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Datenblatt Nitrendipine ~98 % bei Sigma-Aldrich, abgerufen am 16. April 2011 (PDF).
- ↑ Rote Liste Service GmbH (Hrsg.): Rote Liste 2017 – Arzneimittelverzeichnis für Deutschland (einschließlich EU-Zulassungen und bestimmter Medizinprodukte). Rote Liste Service GmbH, Frankfurt/Main, 2017, Aufl. 57, ISBN 978-3-946057-10-9, S. 204.
- ↑ Deutsches Patent DE2117571B2, Erfinder Horst Meyer, Friedrich Bossert, Kurt Vater, angemeldet für Bayer AG. Angemeldet am 10. April 1971.
- ↑ Bayer stellt Vertrieb von Bayotensin akut ein Deutsche Apotheker Zeitung am 6. Mai 2021, abgerufen am 20. Mai 2021.
Auf dieser Seite verwendete Medien
Structural Formula of (S)-Nitrendipin
Synthese von Nitrendipidin (Formelschema)
Structural Formula of (RS)-Nitrendipin
Structural Formula of (R)-Nitrendipin