Nikotinischer Acetylcholinrezeptor
| Nikotinischer Acetylcholinrezeptor | ||
|---|---|---|
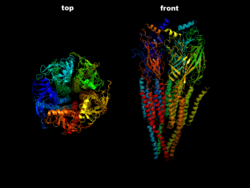 | ||
| Der ACh-n-Rezeptor aus dem Zitterrochen (Torpedo) in Seitenansicht (rechts) und Draufsicht (links) nach PDB 2BG9 | ||
| Masse/Länge Primärstruktur | 2392 = 2*462 + 478 + 517 + 473 Aminosäuren (2α1β1γε) | |
| Sekundär- bis Quartärstruktur | Pentamer ααβδγ oder ααβδε | |
| Transporter-Klassifikation | ||
| TCDB | 1.A.9.1.1 | |
| Bezeichnung | Ligandengesteuerte Ionenkanäle | |
| Vorkommen | ||
| Übergeordnetes Taxon | Mehrzellige Tiere | |
Nikotinische Acetylcholinrezeptoren (nAChR), auch kurz Nikotinrezeptoren, sind membranständige Rezeptoren in verschiedenen Nervenzellen und in Muskelfasern, die als Substrat den Neurotransmitter Acetylcholin (ACh) binden, doch auch durch Nikotin und ähnliche nikotinerge Substanzen aktiviert werden können. Diese ionotropen Rezeptoren bestehen aus fünf Untereinheiten, die neben den rezeptiven Bindungsstellen gemeinsam eine die Zellmembran durchspannende Pore bilden und somit einen ligandengesteuerten Ionenkanal darstellen. Hierbei handelt es sich um einen unspezifischen Kationenkanal, der vor allem für monovalente Na+ und K+ Ionen permeabel ist[1]. Die muskarinischen Acetylcholinrezeptoren sind dagegen metabotrope membranständige Rezeptoren.
Gut untersucht sind die nikotinergen Rezeptoren an der neuromuskulären Endplatte, wo Impulse von Nervenzellen auf Muskelfasern synaptisch übertragen werden. Für die Öffnung des Ionenkanals müssen an einen Rezeptor jeweils zwei ACh-Moleküle binden, was bei hohen Transmitterkonzentrationen eher vorkommt als bei niedrigen. Beim Krankheitsbild der Myasthenia gravis werden diese ACh-Rezeptoren durch Autoimmunprozesse zerstört und damit die Übertragung der neuronalen Signale auf den Muskel gestört.
Aufbau
Dieser Rezeptor wird als Prototyp seiner Klasse angesehen. Er ist verwandt mit dem ionotropen Serotonin-(5-HT3)-Rezeptor, dem GABAA-Rezeptor und dem Glycin-Rezeptor. Der nicotinerge ACh-Rezeptor ist ein zylindrisches Transmembranprotein bestehend aus 5 Untereinheiten (2x α1-, β1-, γ-, δ-Untereinheit), von denen jede jeweils viermal die Zellmembran durchspannt (im ausgewachsenen Muskel ist γ durch ε ersetzt). DNA-Sequenzierungen haben ergeben, dass die beiden α-Untereinheiten wiederum aus acht Untertypen bestehen: α1–α8. Durch das Auftreten verschiedener Untereinheiten, die jeweils einen Rezeptor-Komplex bilden können, entsteht eine Vielzahl von verschiedenen Rezeptor-Isoformen, die sich durch eine unterschiedliche Zusammensetzung der Untereinheiten auszeichnen, unterschiedliche pharmakokinetische Eigenschaften besitzen und spezifisch zwischen Organen und innerhalb des ZNS verteilt sind.[2] So kann man grob zwischen einem Muskeltyp NM und einem Neuronentyp NN der N-Cholinozeptoren unterscheiden, je nachdem, ob sich der nikotinische Rezeptor in der Muskulatur oder dem Nervensystem befindet.
Kinetik
Die α-Untereinheiten des Rezeptors besitzen jeweils eine Bindungsstelle für Acetylcholin (zwei Bindungsstellen pro Rezeptor). Wenn diese Bindungsstellen durch den Transmitter besetzt sind, ändert sich durch die Interaktion mit dem gebundenen Molekül die dreidimensionale Struktur und es eröffnet sich eine Kanalpore, durch die Ionen durch die Zellmembran gelangen können. Dieser Mechanismus wurde erst vor kürzerer Zeit aufgedeckt. Natrium und Calcium-Ionen strömen somit in die Zelle ein, Kalium strömt (in wesentlich geringerer Menge) aus der Zelle hinaus. Durch die Ladungsverschiebungen entsteht ein Strom über die Zellmembran, den man entsprechend seiner Richtung (von außen in die Zelle hinein) als Depolarisation der Zelle bezeichnet, da er die vorbestehende polare Ladungsverteilung an der Zellmembran (innen negativ, außen positiv) vermindert und kurzzeitig sogar umkehren kann.
Der ligandenbesetzte Rezeptor kommt in zwei Formen vor: einmal als geschlossener (A2R) und einmal als offener (A2R*). Diese beiden Zustände können schnell ineinander übergehen. Parallel dazu geht die geschlossene Form (A2R) mit zeitlicher Verzögerung in die inaktive Form (A2I) über (Desensitisierung), die sich unter weiterer Abspaltung von ACh über AI wieder in die geschlossene Form AR umwandelt. Sinkt die Acetylcholin-Konzentration durch die Aktivität der Acetylcholinesterase wieder unter 10 nM, so regeneriert der Rezeptor wieder zur ursprünglichen Form R. Die Zeitkonstante der Desensitisierung (mittlere Zeit zum Schließen des Kanals) beträgt bei einer ACh-Konzentration von 1 mM rund 20–50 ms.
Aufgrund der Brownschen Molekularbewegung diffundieren die ACh-Moleküle nach kurzer Zeit wieder von der Bindungsstelle ab und werden durch das Enzym Acetylcholinesterase zu Cholin und Acetat bzw. Essigsäure abgebaut. Dadurch schließt sich der Rezeptor wieder.
Pharmakologische Beeinflussung
Zahlreiche pflanzliche Alkaloide, tierische Sekrete, Medikamente oder potentielle Giftstoffe entfalten einen wesentlichen Teil ihrer Wirkung, indem sie an diesem nikotinischen ACh-Rezeptor ansetzen.
Beim Muskeltyp NM des Rezeptors in der Membran von Muskelfasern einer neuromuskulären Synapse beispielsweise blockiert das Tubocurarin der Zubereitung Curare aus Lianenpflanzen (etwa Chondodendron tomentosum) als kompetitiver Antagonist reversibel die Anlagerung von ACh an den Rezeptor, das α-Bungarotoxin im Speichel von Giftnattern wie Kraits (etwa Bungarus multicinctus) irreversibel. Beidenfalls wird so quergestreifte Muskulatur der Aktivation durch neuronale Impulse entzogen. Das Pfeilgift Curare wurde dieser Wirkung wegen auch für medizinische Zwecke genutzt. Zeitgenössische muskelentspannende Pharmaka sind etwa Cisatracurium, Pancuronium, Rocuronium als blockierende, sogenannte nicht-depolarisierende Muskelrelaxantien (Benzylisochinoline bzw. Steroid-Derivate). Suxamethonium (Succinylcholin) dagegen ist eine agonistische Substanz, es bindet am ACh-Rezeptor, aktiviert ihn und öffnet ligandensteuernd vorübergehend den Ionenkanal, als sogenanntes depolarisiendes Muskelrelaxans. Dieser Arzneistoff bewirkt ebenfalls eine Muskellähmung, jedoch über einen Depolarisationsblock und daher mit vorangehender Muskelzuckung. Die anschließende Desensitisierung des Rezeptors kann ohne zwischenzeitlichen, ligandenfreien Zustand nicht aufgehoben, der belegte Rezeptor also nicht prompt wieder aktivierbar gemacht werden. Für die Wirkungsdauer von Succinylcholin ist vornehmlich dessen Abbau durch eine Pseudocholinesterase entscheidend (nicht wie bei ACh durch die Acetylcholinesterase).
Der Neuronentyp NN des Rezeptors in der Membran von Nervenzellen kann spezifisch mittels Hexamethonium oder Pentamethonium blockiert werden. Früher wurden diese Arzneimittel als Ganglienblocker benutzt, da sie unter anderem die Erregungsübertragung von prä- auf postganglionäre Neuronen in den Ganglien des peripheren vegetativen Nervensystems unterbrechen; heute ist ein solcher Einsatz wegen der zahlreichen Nebenwirkungen jedoch obsolet. Die Alkaloide Nikotin (etwa in Tabakpflanzen), Coniin (etwa im Schierling) und Cytisin (etwa im Goldregen) aktivieren diesen neuronalen ACh-Rezeptor und sind wegen ihrer in entsprechender Dosierung starken Wirkung auf das vegetative Nervensystem höchst toxisch (Herzstillstand, Atemlähmung).
Medizinische Bedeutung
Beim Krankheitsbild der Myasthenia gravis produziert der Körper Autoantikörper gegen den nicotinergen ACh-Rezeptor vom muskulären Typ und führt daher zu einer Muskelschwäche. Es folgt eine Aufstellung der möglichen Rezeptor-Untereinheiten, der Position ihres Gens im Genom und möglicher Krankheitsbilder bei Mutation desselben.
| UE | Typ | UniProt | Genlocus | OMIM | Pathologie |
|---|---|---|---|---|---|
| α1 | Muskel | P02708 | 2q24-q32 | 100690 | Myasthenia gravis; Multiples Pterygium-Syndrom, letaler Typ; myasthenisches Syndrom (SCCMS, FCCMS) |
| α2 | Neuron | Q15822 | 8p21 | 118502 | Nächtliche Frontallappen-Epilepsie (ENFL4) |
| α3 | Neuron | P32297 | 15q24 | 118503 | Autoimmune Autonome Ganglionopathie;[3] Anfälligkeit für Lungenkrebs (LNCR2); Anfälligkeit für periphere arterielle Verschlusskrankheit (PAOD2) |
| α4 | Neuron | P43681 | 20 | 118504 | Nächtliche Frontallappen-Epilepsie (ENFL1) |
| α5 | Neuron | P30532 | 15q24 | 118505 | Anfälligkeit für Lungenkrebs (LNCR2) |
| α6 | Neuron | Q15825 | 8p22 | 606888 | |
| α7 | Neuron | P36544 | 15q13.3 | 118511 | |
| β1 | Muskel | P11230 | 17p12-p11 | 100710 | Myasthenisches Syndrom (SCCMS, ACHRDCMS) |
| β2 | Neuron | P17787 | 1q21.3 | 118507 | Nächtliche Frontallappen-Epilepsie (ENFL3) |
| β3 | Neuron | Q05901 | 8 | 118508 | |
| β4 | Neuron | P30926 | 15q24 | 118509 | |
| γ | P07510 | 2q33-34 | 100730 | Escobar-Syndrom; Multiples Pterygium-Syndrom, letaler Typ | |
| δ | Q07001 | 2q33-qter | 100720 | Multiples Pterygium-Syndrom, letaler Typ; myasthenisches Syndrom (SCCMS, FCCMS) | |
| ε | ausgew. Muskel | Q04844 | 17p13.2 | 100725 | Myasthenia gravis; myasthenisches Syndrom (SCCMS, FCCMS, ACHRDCMS) |
Siehe auch
Weblinks
- Orphanet:
- Eintrag zu Kongenitales myasthenes Syndrom. In: Orphanet (Datenbank für seltene Krankheiten)
- Eintrag zu Multiples Pterygium-Syndrom, letales. In: Orphanet (Datenbank für seltene Krankheiten)
Einzelnachweise
- ↑ V. Itier, D. Bertrand: Neuronal nicotinic receptors: from protein structure to function. In: FEBS letters. Band 504, Nr. 3, 31. August 2001, S. 118–125, doi:10.1016/s0014-5793(01)02702-8, PMID 11532443.
- ↑ Vgl. Shepard, 2004: The synaptic organization of the brain.
- ↑ Elisabeth P. Golden, Steven Vernino: Autoimmune autonomic neuropathies and ganglionopathies: epidemiology, pathophysiology, and therapeutic advances. In: Clinical Autonomic Research. 15. Mai 2019, doi:10.1007/s10286-019-00611-1.
Auf dieser Seite verwendete Medien
Top and front view to the 3D structure of the pentameric nicotinic acetylcholine receptor.
- Created by S. Jähnichen using PyMol
- Derived from the published structure (source: RCSB PDB Database
- PDB ID: 2BG9
- from Unwin, N. (2005). Refined Structure of the Nicotinic Acetylcholine Receptor at 4A Resolution. J. Mol. Biol. 346:967.
(c) Opossum58, CC BY-SA 3.0
Konformationszustände des nicotinischen ACh-Rezeptors. selbst gezeichnet
(c) Opossum58, CC BY-SA 3.0
nicotinischer ACh-Rezeptor. selbst gezeichnet




