Natriumperiodat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
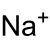  | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumperiodat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | NaIO4 | |||||||||||||||
| Kurzbeschreibung | farb- und geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 213,89 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Dichte | 3,87 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | mäßig in Wasser (91 g·l−1 bei 20 °C)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Natriumperiodat ist eine chemische Verbindung aus der Gruppe der Periodate (genauer das Natriumsalz der Metaperiodsäure). Es liegt in Form eines sehr reaktionsfähigen, brandfördernden, geruch- und farblosen Pulvers vor.
Vorkommen
Natriumperiodat kommt natürlich in geringen Mengen als Beimengung von Chilesalpeter vor.
Gewinnung und Darstellung
Natriumperiodat kann aus Natriumiodat dargestellt werden.[2]
Eigenschaften
Bei Erhitzung über 300 °C zersetzt sich Natriumperiodat, wobei Natriumoxid und Iod (oder bei Anwesenheit von Feuchtigkeit Iodwasserstoff) entstehen. Natriumperiodat kristallisiert tetragonal, Raumgruppe I41/a (Raumgruppen-Nr. 88), mit den Gitterparametern a = 5,337 Å und c = 11,95 Å.[3]
Verwendung
Natriumperiodat wird als Maßlösung eingesetzt. Es kann auch zur Herstellung von 1-Pyrrolin und als Oxidationsmittel (z. B. bei Dihydroxylierungen als Cooxidans) verwendet werden. In der Bioorganischen Chemie dient es zur selektiven Oxidation von aminoterminalen Serinen in Peptiden oder Proteinen. Auf diese Weise werden Glyoxalfunktionen erzeugt. Diese aldehydischen Gruppen können mit primären Aminen in Schiff'sche Base Reaktionen zur Biokonjugation verwendet werden. Aldehydfunktionen können auch mittels Natriumperiodat vermittelter Oxidation aus 1,2-Diolen, welche in Zuckerresten glycosilierter Biomoleküle vorkommen, erzeugt werden.
Sicherheitshinweise
Natriumperiodat selbst brennt nicht, aber es kann bestehende Brände erheblich fördern und reagiert heftig mit brennbaren Stoffen, so dass es bei Kontakt mit solchen zu einer Selbstentzündung kommen kann.
Siehe auch
- Natriumiodat
- Natriumorthoperiodat Na5IO6
- Kaliumperiodat
- Bariumperiodat
Einzelnachweise
- ↑ a b c d e f Eintrag zu Natriumperiodat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6.
- ↑ A. Kalman, D.W.J. Cruickshank: Refinement of the Structure of NaIO4. In: Acta Crystallographica, B26, 1970, S. 1782–1785, doi:10.1107/S0567740870004880.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Struktur des Na+-Ions
Struktur des Periodat-Ions
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances









