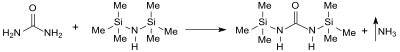
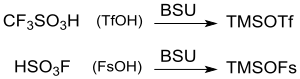N,N′-Bis(trimethylsilyl)harnstoff
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | N,N′-Bis(trimethylsilyl)harnstoff | |||||||||||||||
| Andere Namen | BSU | |||||||||||||||
| Summenformel | C7H20N2OSi2 | |||||||||||||||
| Kurzbeschreibung | farbloser kristalliner Feststoff[1] bzw. farblose Kristallnadeln.[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 204,42 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | gut löslich in Methanol, Ethanol und Diethylether,[2] löslich in Dichlormethan und Dimethylsulfoxid,[4] in Diethylether und Aceton[5], reagiert mit Wasser | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
N,N′-Bis(trimethylsilyl)harnstoff BSU ist ein Harnstoffderivat, bei dem jeweils ein Wasserstoffatom an beiden Aminogruppen durch eine Trimethylsilylgruppe (TMS-Schutzgruppe) ersetzt ist. BSU wird vorteilhaft als Silylierungsreagens für Alkohole und Carbonsäuren eingesetzt, da es keiner Säure- oder Basekatalyse bedarf und das Nebenprodukt Harnstoff in unpolaren Lösungsmitteln, wie z. B. Dichlormethan CH2Cl2 praktisch unlöslich ist.[6][4]
Herstellung
Die Synthese von N,N′-Bis(trimethylsilyl)harnstoff wurde erstmals 1963 aus dem Arbeitskreis von Ulrich Wannagat berichtet.[2]
BSU entsteht beim Erhitzen von Harnstoff mit überschüssigem Hexamethyldisilazan HMDS in 98 %iger Rohausbeute. Das Produkt ist jedoch mit Spuren von Trimethylsilylisocyanat Me3SiNCO, HMDS, und Hexamethyldisiloxan Me3SiOSiMe3 verunreinigt und als Silylierungsreagens selbst nach Sublimation wenig brauchbar.[7]
Die Umsetzung von Harnstoff mit Hexamethyldisilazan in Gegen-wart (flüchtiger) saurer Katalysatoren, wie z. B. Ammoniumchlorid, Essigsäure oder Chlorwasserstoff, liefert auch in industriellen Reaktionsansätzen Reinausbeuten über 98 % mit Silylierungs-aktivitäten um 100 %.[7]
Eigenschaften
N,N′-Bis(trimethylsilyl)harnstoff ist ein farbloser, kristalliner Feststoff, der sich in vielen organischen Lösungsmitteln löst und mit Wasser unter Bildung von Harnstoff und Hexamethyldisiloxan reagiert.[8] Die Substanz sollte daher unter Feuchtigkeits-ausschluss und in inerter Atmosphäre gelagert werden. Die stark schwankenden Werte der angegebenen Schmelzpunkte sind auf Verunreinigungen des Produkts zurückzuführen, die sich auch in verminderten Silylierungsaktivitäten niederschlagen. Vakuumsublimation verunreinigter Produkte liefert unter erheblichen Verlusten nur ein etwas reineres Produkt.[7]
Anwendungen
Die Silylierung ist eine Gleichgewichtsreaktion, bei der ein aktives Wasserstoffatom H an einem Heteroatom X durch einen Trimethylsilylrest TMS ersetzt wird.
Die Entfernung des entstehenden Moleküls H-Y (Harnstoff im Fall von BSU, Ammoniak NH3 im Fall von HMDS) ist für eine hohe Produktausbeute entscheidend. Silylierungsmittel, wie z. B. Chlortrimethylsilan TMS-Cl oder Trimethylsilyltrifluormethansulfonat TMSOTf, die als Ester starker Säuren aufgefasst werden können, erfordern den Einsatz von Basen wie Triethylamin oder Pyridin zum Abfangen der bei der Reaktion entstehenden Säuren. Silazanartige Reagentien wie BSU dagegen sind schwache Basen und reagieren unter milden Bedingungen mit primären, sekundären und tertiären Alkoholen, Phenolen und Carbonsäuren.[8] Dabei werden in der Regel Produktausbeuten über 90 % erzielt.[6]
Ein Sonderfall der Silylierung von Hydroxygruppen ist die Reaktion von N,N′-Bis(trimethylsilyl)harnstoff mit Carbamidperoxid (festes Wasserstoffperoxid) zu Bis(trimethylsilyl)peroxid, einem wasserfreien geschützten Wasserstoffperoxid.[9]
Die Reaktion verläuft in Dichlormethan, in dem der entstehende Harnstoff ausfällt. Das flüssige Produkt (86 % Ausbeute) wird durch Destillation isoliert.
Dipolar-aprotische Lösungsmittel, wie Acetonitril, Dimethylformamid oder Pyridin, in denen sich auch Polyhydroxyverbindungen, z. B. Glucose oder Glucoside wie Methyl-α-D-glucopyranosid löslich sind, fördern die Silylierungsreaktion, wobei das in geringen Mengen zugesetzte Silylspaltungsreagens Tetrabutylammoniumfluorid TBAF als Initiator wirken soll.[10][11]
Zur Steigerung der Reaktivität werden oft auch Kombinationen von Silylierungsmitteln eingesetzt, wie z. B. Hexamethyldisilazan + Trimethylchlorsilan. Alternativ dazu können hochreaktive Silylreagentien, wie TMSOTf oder Trimethylsilylfluorsulfonat TMSOFs auch in situ aus den Supersäuren Trifluormethansulfonsäure[12] bzw. Fluorsulfonsäure[13] in katalytischen Mengen erzeugt werden.
So werden sehr hohe Produktausbeuten durch Einsatz des preisgünstigen N,N′-Bis(trimethylsilyl)harnstoff statt der teuren Triflate bzw. Fluorsulfonate ermöglicht. Mit in situ erzeugtem TMSOFs können praktisch quantitative Ausbeuten bei der Reduktion von Benzaldehyd-dimethylacetal mittels Triethylsilan
oder der Bildung der Ketalisierung von 4-Methylcyclohexanon mit 1,2-Bis(trimethylsilyloxy)ethan (silyliertem Ethylenglycol) erzielt werden.
Primäre Amine liefern mit BSU die entsprechenden N-Trimethylsilylamine, die mit Styroloxid in guten Ausbeuten (64–84 %) zu 1-Phenylethanolaminen reagieren.[14]
Die mengenmäßig wichtigste Anwendung von N,N′-Bis(trimethylsilyl)harnstoff lag in der Vergangenheit bei den Silylierungsschritten in den mehrstufigen chemischen Umwandlungen von Penicillin G unter Ringerweiterung des fünfgliedrigen Penam- in einen sechsgliedrigen Cephem-Ring zum Cephalosporin G und in der anschließenden Acylierung der Stammverbindungen 7-Aminodesacetoxycephalosporansäure (7-ADCA) bzw. 7-Aminocephalosporansäure (7-ACA) (aus Cephalosporin C) zu halbsynthetischen Cephalosporinen.[15] Obwohl die Optimierung industrieller chemischer Verfahren die Ausbeute auf der ersten Stufe von Penicillin G zum Penicillin G-sulfoxid bis auf 92,4 % bei einer Reinheit von >98,3 % und auf der zweiten Stufe vom Penicillin G-sulfoxid zum Cephalosporin G bis auf 94 % bei einer Reinheit von >98 % steigern konnten[16], haben effizientere und insbesondere umweltfreundlichere enzymatische Verfahren diese Anwendungen von BSU weitgehend obsolet werden lassen.
Literatur
- Silylating Agents. (PDF; 716 KB) In: sigmaaldrich.com. Fluka Chemie AG, abgerufen am 20. Juli 2018 (englisch).
Einzelnachweise
- ↑ a b Datenblatt N,N'-Bis-(trimethylsilyl)-harnstoff bei Sigma-Aldrich, abgerufen am 21. Juli 2018 (PDF).
- ↑ a b c U. Wannagat, H. Bürger, C. Krüger, J. Pump: Beiträge zur Chemie der Silicium-Stickstoff-Verbindungen. XII Einige Silicium-Harnstoff-Verbindungen. In: Z. Anorg. Allg. Chem. Band 321, Nr. 3–4, 1963, S. 208–216, doi:10.1002/zaac.19633210313.
- ↑ a b c Datenblatt N,N’-Bis(trimethylsilyl)urea bei AlfaAesar, abgerufen am 21. Juli 2018 (PDF) (JavaScript erforderlich).
- ↑ a b c J. Wisniewski Grissom: N,N'-Bis(trimethylsilyl)urea. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rb223.
- ↑ Daniel R. Knapp: Handbook of Analytical Derivatization Reactions. John Wiley & Sons, New York, NY, U.S.A. 1979, ISBN 0-471-03469-X, S. 35.
- ↑ a b W. Verboom, G.W. Visser, D.N. Reinhoudt: N,N‘-Bis[trimethylsilyl]-urea: A useful silylating agent for alcohols and carboxylic acids. In: Synthesis. Band 10, 1981, S. 807–809, doi:10.1055/s-1981-29605.
- ↑ a b c Patent DE2553932A1: Verfahren zur Herstellung von N,N‘-Bis-trimethylsilylharnstoff. Angemeldet am 1. Dezember 1975, veröffentlicht am 2. Juni 1977, Anmelder: Dynamit Nobel AG, Erfinder: H.-J. Kötzsch, H.-J. Vahlensieck.
- ↑ a b M.T. El Gihani, H. Heaney: The use of bis[trimethylsilyl]acetamide and bis[trimethylsilyl]urea for protection and as control reagents in synthesis. In: Synthesis. Band 4, 1998, S. 357–375, doi:10.1055/s-1998-2043.
- ↑ W.P. Jackson: A simple preparation of bis(trimethylsilyl)peroxide. In: Synlett. Band 9, 1990, S. 536–536, doi:10.1055/s-1990-21157.
- ↑ D.A. Johnson: Simple procedure for the preparation of trimethylsilyl ethers of carbohydrates and alcohols. In: Carbohyd. Res. Band 237, 1992, S. 313–318, doi:10.1016/S0008-6215(92)84254-P.
- ↑ Y. Tanabe, M. Murakami, K. Kitaichi, Y. Yoshida: Mild, effective and selective method for the silylation of alcohols using silazanes promoted by catalytic tetrabutylammonium fluoride. In: Tetrahedron Lett. Band 35, Nr. 45, 1994, S. 8409–8412, doi:10.1016/S0040-4039(00)74419-4.
- ↑ M. El Gihani, H. Heaney: The use of bis-trimethylsilyl-acetamide and -urea in trimethylsilyl trifluoromethanesulfonate catalysed reactions. In: Synlett. Band 6, 1993, S. 433–434, doi:10.1055/s-1993-22485.
- ↑ M. El Gihani, H. Heaney: A convenient alternative route to trimethylsilylfluorosulfonate for use in catalytic reactions. In: Synlett. Band 8, 1993, S. 583–584, doi:10.1055/s-1993-22538.
- ↑ R.K. Atkins, J. Frazier, L.L. Moore, L.O. Weigel: Alkylation of N-trimethylsilylated primary amines with arylethylene oxides. An efficient synthesis of 1-phenethanolamines. In: Tetrahedron Lett. Band 27, Nr. 22, 1986, S. 2451–2454, doi:10.1016/S0040-4039(00)84553-0.
- ↑ Alle Bruggink (Hrsg.): Synthesis of β-Lactam Antibiotics: Chemistry, Biocatalysis & Process Integration. Springer Science+Business Media, Dordrecht 2001, ISBN 978-94-010-3851-5, S. 15.
- ↑ P. Salehpour, R. Yegani, R. Hajmohammadi: Determination of optimal operation conditions for production of Cephalosporin G from Penicillin G potassium. In: Org. Process Res. Dev. Band 16, Nr. 9, 2012, S. 1507–1512, doi:10.1021/op300076q.
Auf dieser Seite verwendete Medien
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Synthese von Trimethylsilyl-Supersäuren
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Reduktion von Benzaldehyd-dimethylacetal mit Triethylsilan / BSU+FsOH
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Silylierungsreaktion (schematisch)
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Synthese von N,N'-Bis(trimethylsilyl)harnstoff BSU
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Silylierung von Methylglucosid mit BSU
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Silylierung von Alkoholen, Phenolen und Carbonsäuren mit N,N'-Bis(trimethylsilyl)harnstoff BSU
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Bildung von 1-Phenylethanolaminen mit BSU
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Strukturformel von N,N'-Bis(trimethylsilyl)harnstoff
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Synthese von Cyclohexanonketalen mit BSU+FsOH
Autor/Urheber: ChemDoc 2010, Lizenz: CC BY-SA 4.0
Synthese von Bis(trimethylsilyl)peroxid mit BSU