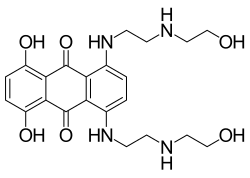
Mitoxantron
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Mitoxantron | |||||||||||||||
| Andere Namen | 1,4-Dihydroxy-5,8-bis({2-[(2-hydroxyethyl)amino]ethyl}amino)-9,10-anthrachinon (IUPAC) | |||||||||||||||
| Summenformel | C22H28N4O6 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | L01DB07 | |||||||||||||||
| Wirkstoffklasse | Antibiotika mit zytostatischer Wirkung | |||||||||||||||
| Wirkmechanismus | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 444,48 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Mitoxantron ist ein zytostatisch wirksamer Arzneistoff. Es wird für die Krebs-Therapie eingesetzt.
Herkunft und Herstellung
Mitoxantron ist ein zytotoxisches Antibiotikum der Gruppe der Anthracendione.
Wirkungsmechanismus
Mitoxantron lagert sich der DNA durch Wasserstoffbrückenbildung an (Interkalation). Nachfolgend verursacht Mitoxantron Quervernetzungen und Strangbrüche der DNA. Zusätzlich behindert Mitoxantron die Bildung von RNA und hemmt die Topoisomerase II stark, welche für die Entspiralisierung und Reparatur beschädigter DNA verantwortlich ist. Mitoxantron wirkt durch die Mechanismen zytotoxisch (zellgiftig) auf teilende und ruhende Zellen, was eine Wirksamkeit in Unabhängigkeit vom Zellzyklus bedeutet.
Die Wirkungen von Mitoxantron führen zu einer Hemmung des Wachstums von T-, B-Lymphozyten und Makrophagen. Bei letzteren wird die Präsentation von Antigenen sowie die Sekretion von Interferon-γ, Tumornekrosefaktor-α und Interleukin-2 unterdrückt.
Obwohl Mitoxantron mit den Anthracyclin-Antibiotika Doxorubicin, Daunorubicin, Idarubicin und Epirubicin strukturell verwandt ist, kann es im Gegensatz zu diesen keine Chinon-artigen freien Radikale erzeugen.
Pharmakokinetik
- Bioverfügbarkeit: 100 %, da ausschließlich intravenös verabreicht
- Proteinbindung: 78 %
- Verteilungsvolumen: 1875–2248 l/m2
- Plasmahalbwertszeit: α-Phase 0,14 h; β-Phase 3,1 h; γ-Phase 36–215 h
Die Pharmakokinetik von Mitoxantron entspricht einem 3-Kompartiment-Modell (3 Phasen-Modell: alpha-, beta- und gamma-Phase).
Aufnahme und Bioverfügbarkeit
Die Gewebeverteilung von Mitoxantron nach einer einzelnen intravenösen Gabe ist sehr hoch. Das Verteilungsvolumen beträgt über 1000 L/m2. Die Gewebekonzentrationen von Mitoxantron übertreffen die Konzentrationen im Plasma während der gamma-Phase. Bei Patienten mit einer Dosis von 15–90 mg/m2 besteht ein lineares Verhältnis zwischen der Dosis und der Fläche unterhalb der Konzentrations-Zeit-Kurve (area under curve, AUC).
Verstoffwechselung (Metabolismus)
Mitoxantron wird nicht über die Cytochrom-P450-Enzyme 1A2, 2A6, 2C9, 2C19, 2D6, 2E1 und 3A4 verstoffwechselt. Mitoxantron ist jedoch ein schwacher Induktor des Cytochrom-P450-Enzyms 2E1.
Ausscheidung (Elimination)
Die mittlere Halbwertzeit für Mitoxantron beträgt 6–12 Minuten in der alpha-Phase, 1,1–3,1 Stunden in der beta-Phase und 23–215 Stunden (Median 75 Stunden) in der gamma-Phase (auch terminale Eliminationshalbwertzeit). Ausgeschieden wird Mitoxantron über den Urin und Stuhl als unveränderte Substanz oder inaktive Metaboliten: 11 % einer Dosis von Mitoxantron wurden innerhalb von 5 Tagen über den Urin, 25 % über den Stuhl ausgeschieden. 65 % der im Urin nachweisbaren Substanz bestand aus unverändertem Mitoxantron, die verbleibenden 35 % bestanden aus Monocarboxyl- und Dicarboxylderivaten und Glukuronidkonjugaten.
Anwendungsgebiete
Mitoxantron wird als Zytostatikum in der Behandlung von Krebserkrankungen eingesetzt. In der Behandlung der Multiplen Sklerose spielt es keine Rolle mehr.
Erwachsene
- Akute myeloische Leukämie (AML): Bei der Behandlung der akuten myeloischen Leukämie erfolgt die Gabe von Mitoxantron zumeist in Kombination mit Cytarabin als sogenannte HAM- oder haM-Blöcke. Diese Blöcke sind effektiv in der Bekämpfung der AML, aber auch nebenwirkungsträchtig, insbesondere die Knochenmarktoxizität ist hoch.
- Mammakarzinom (metastasiert)
- Prostatakarzinom (fortgeschritten)
- Non-Hodgkin-Lymphom (NHL)
- obsolet: Multiple Sklerose: Mitoxantron ist zur Therapie der schubförmig verlaufenden Multiplen Sklerose zugelassen. Aufgrund des Nebenwirkungsprofils, der daraus resultierenden kumulativen Gesamtdosis (Dosis, die über die Lebenszeit maximal eingenommen werden kann) und der Verfügbarkeit hochwirksamer anderer MS-Therapeutika sollte es bei der Multiplen Sklerose nicht mehr zur Anwendung kommen.[5][6]
Kinder und Jugendliche
- Akute myeloische Leukämie (AML): Bei der Behandlung der akuten myeloischen Leukämie erfolgt die Gabe von Mitoxantron zumeist in Kombination mit Cytarabin als sogenannte HAM- oder haM-Blöcke. Diese Blöcke sind effektiv in der Bekämpfung der AML, aber auch nebenwirkungsträchtig, insbesondere die Knochenmarktoxizität ist hoch.
- Multiple Sklerose (MS): Der Einsatz von Mitoxantron bei der Multiplen Sklerose im Kindes- und Jugendalter erfolgt nach den Erfahrungen im Erwachsenenalter. Die Anwendung von Mitoxantron bei Kindern und Jugendlichen mit Multipler Sklerose ist trotz bestehender Vorerfahrungen experimentell – eine Zulassung für diese Indikation bei Kindern und Jugendlichen besteht nicht.
Verabreichung
Mitoxantron wird intravenös als Infusion verabreicht. Als Begleitmedikation gegen eventuell auftretende Übelkeit wird zuvor z. B. Ondansetron ebenfalls intravenös verabreicht.
Nebenwirkungen
Unter der Gabe von Mitoxantron kommt es häufig zu
- Übelkeit und Erbrechen
- Appetitlosigkeit
- Haarausfall (Alopezie)
- Schleimhautschädigung (Mukositis).
- Knochenmarktoxizität: Mitoxantron hat eine deutlich toxische Wirkung auf das Knochenmark, aus der eine Anämie, Thrombopenie und Leukopenie resultieren kann. Zehn Tage nach Mitoxantron-Gabe ist der Nadir (Tiefpunkt) der Blutkörperchenzahlen erreicht, nach 21 Tagen erfolgt in der Regel die Erholung des Knochenmarks (und auch des Blutbildes). In Abhängigkeit von der Kombination mit anderen Zytostatika (Beispiel Cytarabin) kann diese Nebenwirkung verstärkt vorkommen oder länger anhalten.
- Infektionen infolge der Leukopenie und Neutropenie (beispielsweise in Form von Atemwegsinfektionen, Harnwegsinfektionen)
- Kardiotoxizität (Herzschädigung): Mitoxantron besitzt wie die strukturverwandten Anthracycline eine signifikant kardiotoxische Wirkung. Zum einen können zeitweilige (umkehrbare) Herzrhythmusstörungen auftreten. Zum anderen und deutlich schwerwiegender ist das Auftreten eines Mitoxantron-bedingten toxischen Kardiomyopathie (Herzmuskelschaden). Dieser führt zumeist zu einer irreversiblen Herzinsuffizienz, die bisweilen eine Herztransplantation erforderlich macht. Als Sicherheitsmaßnahme zur Früherkennung von Herzmuskelschäden ist daher die regelmäßige Durchführung von Echokardiographien (Herzultraschall), mindestens einmal jährlich, dringend empfehlenswert. Außerdem gibt es eine kumulative Gesamtdosis, die nicht überschritten werden sollte. Bei Patienten mit bekannten Herzerkrankungen sollte die Substanz nur mit besonderer Vorsicht eingesetzt werden.
- Lokal reizend: Wenn Mitoxantron versehentlich neben die Vene (paravasal) appliziert wird, kommt es zu einer schmerzhaften Gewebereizung mit nur langsam verblassender blauer Hautverfärbung.
- Als Folge der Behandlung mit Mitoxantron insbesondere in Kombination mit Etoposid und Teniposid kann eine therapieassoziierte Leukämie (Sekundärleukämie als Sekundrämalignom) auftreten. Diese kommt bei 0,05–0,1 % der mit Mitoxantron behandelten Patienten vor.
Gegenanzeigen und Vorsichtsmaßnahmen
- Absolute Kontraindikationen
- Überempfindlichkeit gegenüber Mitoxantron
- Schwangerschaft
- Stillzeit
- Vorliegende schwere Myelosuppression
- Intrathekale Anwendung
- Mitoxantron ist nicht angezeigt zur intraarteriellen Injektion
- Vorhofflimmern oder sonstige Herzrhymusstörungen, das es möglicherweise eine Verstärkung verursacht
- Vorsichtsmaßnahmen für die Anwendung
- Herzinsuffizienz
- Infektionen sollten vor der Behandlung mit Mitoxantron behandelt werden
- Impfungen mit Lebendimpfstoff wird generell nicht empfohlen, da während einer Immunsuppression kaum Antikörper gebildet werden können
- Bei Patienten mit schwerer Leberinsuffizienz kann die Elimination vermindert sein, Mitoxantron soll bei diesen Patienten mit Vorsicht angewendet werden.[7]
Kosten
Die Kosten für eine Infusion mit Mitoxantron sind je nach Statur des Patienten und der Dosierung unterschiedlich. Die Kosten für 12 mg des Medikaments Ralenova® belaufen sich auf etwa 200 EUR.
HandelsnamenFkle
Ebexantron (A), Haemato-tron (D), Novantron (D, A, CH), Onkotrone (D), Ralenova (D), diverse Generika (D, A, CH)
Weblinks
- Monographie der British Columbia Cancer Agency Stand: 1. Dezember 2002. Frei zugänglich.
- US-amerikanische Packungsbeilage Mitoxantron (PDF; 1,3 MB) Stand: 13. Oktober 2000. Frei zugänglich.
Einzelnachweise
- ↑ The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1073, ISBN 978-0-911910-00-1.
- ↑ Eintrag zu Mitoxantron. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Juni 2019.
- ↑ a b Datenblatt Mitoxantrone dihydrochloride bei Sigma-Aldrich, abgerufen am 10. April 2011 (PDF).
- ↑ Eintrag zu Mitoxantrone in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ Heinz Wiendl et al.: Multiple Sklerose Therapie Konsensus Gruppe (MSTKG): Positionspapier zur verlaufsmodifizierenden Therapie der Multiplen Sklerose 2021 (White Paper). In: Der Nervenarzt. Band 92, Nr. 8, 2021, S. 773–801, doi:10.1007/s00115-021-01157-2, PMID 34297142, PMC 8300076 (freier Volltext).
- ↑ Bernhard Hemmer et al.: Leitlinie Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und MOG-IgG-assoziierten Erkrankungen. In: Deutsche Gesellschaft für Neurologie (DGN). 2023, abgerufen am 5. November 2023.
- ↑ Zusammenfassung der Merkmale des Arzneimittels (Fachinformation) von Mitoxantron-GRY® – GRY-Pharma GmbH.
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Skeletal formula of mitoxantrone. Style made to match Image:Methylprednisolone.svg by Calvero. Created using ACD/ChemSketch 10.0 and Inkscape.

