Maxwell-Boltzmann-Verteilung
| Parameter | |
| Definitionsbereich | |
| Wahrscheinlichkeitsdichte | |
| Kumulierte Verteilungsfunktion | |
| Erwartungswert | |
| Modus | |
| Varianz | |
| Wölbung | |
| Entropie (in nats) | (: Euler-Mascheroni-Konstante) |
Die Maxwell-Boltzmann-Verteilung oder auch maxwellsche Geschwindigkeitsverteilung ist eine Wahrscheinlichkeitsdichte der statistischen Physik und spielt in der Thermodynamik, speziell der kinetischen Gastheorie, eine wichtige Rolle. Sie beschreibt die statistische Verteilung des Betrags der Teilchengeschwindigkeiten in einem idealen Gas im thermodynamischen Gleichgewicht bei ruhendem Schwerpunkt. Benannt wird sie nach James Clerk Maxwell und Ludwig Boltzmann, die sie 1860 erstmals hergeleitet haben. Sie ergibt sich aus der Boltzmann-Statistik.
Wegen der vereinfachenden Voraussetzung eines idealen Gases zeigt die Geschwindigkeitsverteilung der Teilchen eines realen Gases Abweichungen. Jedoch ist bei geringer Dichte und hoher Temperatur die Maxwell-Boltzmann-Verteilung für die meisten Betrachtungen ausreichend.
Herleitung der Geschwindigkeitsverteilung in der kinetischen Gastheorie
Herleitung mit Hilfe des Boltzmann-Faktors
Die kinetische Energie eines Teilchenzustands im idealen Gas ist durch
gegeben, und die Wahrscheinlichkeit, dass er im thermodynamischen Gleichgewichtszustand des Teilchensystems von einem Teilchen besetzt ist, durch den Boltzmann-Faktor
- .
Darin ist die Masse des Teilchens, die Boltzmann-Konstante und die absolute Temperatur. Gefragt ist nach dem Anteil von Molekülen mit Betrag der Geschwindigkeit in einem Intervall . Die entsprechende Zustandsdichte ist aus der Grundannahme zu ermitteln, dass die Zustandsdichte im dreidimensionalen Raum der Geschwindigkeitskomponenten konstant ist. Nach haben alle Zustände gleicher kinetischer Energie den Abstand vom Ursprung, füllen hier also eine Kugeloberfläche der Größe . Zum Intervall gehört dann das Volumenelement . Folglich ist der gesuchte Anteil von Molekülen gleich dem Produkt aus dem Volumenelement, dem für das ganze Volumenelement konstanten Boltzmann-Faktor und einem konstanten Normierungsfaktor :[1]
Der Normierungsfaktor ergibt sich daraus, dass das Integral der Wahrscheinlichkeitsdichte den Wert 1 hat.
Herleitung mit Hilfe der Normalverteilung der Komponenten der Geschwindigkeit
Nach der kinetischen Gastheorie bewegen sich in einem idealen Gas bei Temperatur (in Kelvin) nicht alle Gasteilchen mit der gleichen Geschwindigkeit, sondern zufällig verteilt mit verschiedenen Geschwindigkeiten. Es wird hierbei keine Raumrichtung bevorzugt. Mathematisch lässt sich dies so formulieren, dass die Komponenten des Geschwindigkeitsvektors der Gasteilchen der Masse unabhängig voneinander und normalverteilt sind, mit den Parametern
- mittlere Geschwindigkeit: , und Streuung der Geschwindigkeiten
Die Dichte der Verteilung von im dreidimensionalen Geschwindigkeitsraum, hier mit bezeichnet, ergibt sich somit als das Produkt der Verteilungen der drei Komponenten:
Zur Herleitung der Maxwell-Boltzmann-Verteilung muss man über alle Teilchen mit gleichem Geschwindigkeitsbetrag integrieren (bzw. anschaulich diese „aufsummieren“). Diese liegen auf einer Kugelschale mit Radius und infinitesimaler Dicke um die Geschwindigkeit 0:
Dabei bezeichnet das o. g. Integral über alle Vektoren mit Beträgen im Intervall . Da in die Definition von nur der quadrierte Betrag der Geschwindigkeiten eingeht (siehe Definition oben), der sich im infinitesimalen Intervall nicht ändert, ist das Integral einfach umzuformen:
Hierin bleibt nur noch das einfache Volumenintegral zu lösen. Es ergibt gerade das Volumen der infinitesimalen Kugelschale und man erhält so die gesuchte Maxwell-Boltzmann-Verteilung:
Bedeutung und Anwendungsbereich
Folgerungen aus den Gleichungen
- Aus obigen Gleichungen folgt, dass der Anteil der Teilchen im Geschwindigkeitsintervall direkt proportional zu selbst ist, solange konstant bleibt. Wird also geringfügig erhöht bzw. bezieht man mehr Geschwindigkeiten mit in das Intervall ein, unter der zusätzlichen Annahme Temperatur und molare Masse seien konstant, so steigt die Anzahl der in ihm befindlichen Teilchen bis auf geringe Abweichungen proportional zu an. Mit anderen Worten: Die Verteilungsfunktion ist differenzierbar.
- Die Verteilungsfunktion besitzt eine abfallende Exponentialfunktion der Form mit . Da der Ausdruck sich bei konstanter Temperatur und konstanter molarer Masse direkt proportional zum Quadrat der Teilchengeschwindigkeit verhält, lässt sich hieraus schlussfolgern, dass die Exponentialfunktion und damit in eingeschränktem Umfang auch der Anteil der Moleküle für große Geschwindigkeiten sehr klein und dementsprechend für kleine Geschwindigkeiten sehr groß wird (für den exakten Zusammenhang siehe die Abbildungen zur Rechten).
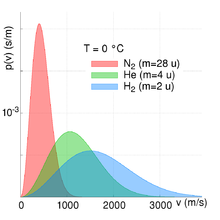
- Für Gase mit einer großen molaren Masse wird der Ausdruck , unter Annahme einer konstanten Temperatur, ebenfalls sehr groß und die Exponentialfunktion nimmt folglich schneller ab. Dies bedeutet, dass die Wahrscheinlichkeit schwere Moleküle bei großen Geschwindigkeiten anzutreffen sehr klein ist und dementsprechend sehr groß für leichtere Moleküle mit einer geringen molaren Masse (siehe Abbildung oben rechts).
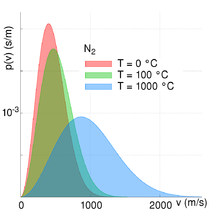
- Im gegensätzlichen Fall einer großen Temperatur und einer konstanten molaren Masse wird der Ausdruck sehr klein und die Exponentialfunktion geht dementsprechend bei einer ansteigenden Geschwindigkeit langsamer gegen Null. Bei einer sehr hohen Temperatur ist der Anteil der schnellen Teilchen daher größer als bei einer niedrigeren Temperatur (siehe Abbildung unten rechts).
- Je geringer die Geschwindigkeit, desto stärker nimmt der quadratische Ausdruck außerhalb der Exponentialfunktion ab. Dies bedeutet, dass auch der Anteil der schnelleren Moleküle bei geringen Geschwindigkeiten schneller abnimmt als die Geschwindigkeit selbst, im Gegenzug jedoch auch, dass dieser bei einer Geschwindigkeitszunahme quadratisch zunimmt.
Alle anderen Größen bedingen, dass sich der Anteil der Teilchen bei einer bestimmten Geschwindigkeit immer im Intervall zwischen null und eins bewegt (). Die beiden Abbildungen zur Rechten verdeutlichen die Abhängigkeit der Maxwell-Boltzmann-Verteilung von Teilchenmasse und Temperatur des Gases. Mit steigender Temperatur nimmt die durchschnittliche Geschwindigkeit zu und die Verteilung wird gleichzeitig breiter. Mit steigender Teilchenmasse hingegen nimmt die durchschnittliche Geschwindigkeit ab und die Geschwindigkeitsverteilung wird gleichzeitig schmaler. Dieser Zusammenhang zwischen Teilchengeschwindigkeit und Temperatur bzw. Teilchengeschwindigkeit und Teilchenmasse/molare Masse ist hierbei auch quantitativ beschreibbar. Siehe hierzu den Abschnitt quadratisch gemittelte Geschwindigkeit.
Bedeutung für die Thermodynamik
Die Maxwell-Boltzmann-Verteilung erklärt beispielsweise den Prozess der Verdunstung. Beispielsweise kann feuchte Wäsche bei Temperaturen von 20 °C trocknen, da es in dieser Verteilungskurve einen geringen Anteil von Molekülen mit der erforderlich hohen Geschwindigkeit gibt, welche sich aus dem Flüssigkeitsverband lösen können. Es wird also auch bei niedrigen Temperaturen immer einige Moleküle geben, die schnell genug sind, die Anziehungskräfte durch ihre Nachbarn zu überwinden und vom flüssigen oder festen Aggregatzustand in den gasförmigen Aggregatzustand überzugehen, was man als Verdampfung bzw. Sublimation bezeichnet. Umgekehrt gibt es aber auch unter den vergleichsweise schnellen Teilchen des Gases immer einige, die keine ausreichende Geschwindigkeit besitzen und daher wieder vom gasförmigen in den flüssigen oder festen Aggregatzustand wechseln, was man als Kondensation bzw. Resublimation bezeichnet. Diese Vorgänge werden unter dem Begriff der Phasenumwandlung zusammengefasst, wobei sich zwischen Teilchen, die in die Gasphase eintreten, und Teilchen, die aus der Gasphase austreten, insofern es keine Störungen von außen gibt, ein dynamisches Gleichgewicht einstellt. Dieses ist Untersuchungsgegenstand der Gleichgewichtsthermodynamik, daher nennt man es auch thermodynamisches Gleichgewicht. Die Teilchen der gasförmigen Phase üben hierbei im Gleichgewichtszustand einen Druck aus, den man als Sättigungsdampfdruck bezeichnet. Grafisch dargestellt wird das Phasenverhalten von Stoffen in deren Phasendiagramm.
Siehe auch: Zustandsgleichung, Fundamentalgleichung, Thermodynamisches Potenzial, Ideales Gas, Reales Gas, Tripelpunkt, Kritischer Punkt
Teilchengeschwindigkeiten
Bei allen Verteilungen wird vorausgesetzt, dass ein Bezugspunkt gewählt wird, der sich gegenüber dem Schwerpunkt des Gases nicht bewegt, anderenfalls läge keine Symmetrie der Geschwindigkeitsverteilung vor und die Gasmasse bewegt sich als Ganzes. Die Berechnungen erfolgen mit der kontinuierlichen Funktion für die Wahrscheinlichkeitsdichte, vorangestellt wird zur Klärung der Bedeutung die Definition, die für endliche Teilchenzahl gilt.
Wahrscheinlichste Geschwindigkeit
Die wahrscheinlichste Geschwindigkeit
ist die Geschwindigkeit, an der die Dichtefunktion ihren maximalen Wert hat. Sie kann aus der Forderung berechnet werden. ist hierbei die Teilchenmasse und ist die molare Masse des Stoffes.
Mittlere Geschwindigkeit
Die mittlere Geschwindigkeit ist der Durchschnittswert
Hierbei ist die Gesamtzahl der Teilchen und die () ihre einzelnen Geschwindigkeiten. Fasst man die Teilchen mit jeweils gleicher Geschwindigkeit zusammen, ergibt sich
Als Lösung des Integrals erhält man:
Quadratisch gemittelte Geschwindigkeit
Die quadratisch gemittelte Geschwindigkeit ist definiert durch:
Aus der kinetischen Gastheorie ergibt sich folgende Zustandsgleichung:
Die empirisch ermittelte Zustandsgleichung idealer Gase ist hierbei:
Setzt man den Ausdruck gleich, erhält man:
Umgestellt nach der Wurzel aus erhält man schließlich:
Die quadratisch gemittelte Geschwindigkeit der Gasteilchen ist damit direkt proportional zur Quadratwurzel der Temperatur, sofern die Molekülmasse sich nicht (z. B. durch eine chemische Reaktion) ändert. Eine Verdopplung der Temperatur auf der Kelvin-Skala führt zu einer Erhöhung der quadratisch gemittelten Geschwindigkeit um den Faktor . Umgekehrt ist auf diesem Wege die Temperatur durch die kinetische Gastheorie definierbar.
Zum gleichen Ergebnis kommt man auch, wenn man in folgender Gleichung substituiert und anschließend von 0 bis integriert:
Die quadratisch gemittelte Geschwindigkeit ist dabei auch ein Maß für die mittlere kinetische Energie (Ekin) der Moleküle:
Diese Aussage kann auch unter Benutzung des Gleichverteilungssatzes gewonnen werden, da es sich um einen Ensemblemittelwert für ein Gasteilchen mit drei Freiheitsgraden handelt.
Harmonischer Mittelwert
Für Zwecke der Stoßzeiten usw. benötigt man einen weiteren Mittelwert, harmonischer Mittelwert genannt. Der harmonische Mittelwert ist definiert durch:
Hierbei sind () die einzelnen Geschwindigkeiten der Teilchen und deren Gesamtzahl.
Durch Substitution von
- und
und Integration erhält man:
oder
Beziehungen zwischen den Geschwindigkeiten

Im Bild zur Rechten ist die maxwell-boltzmannsche Geschwindigkeitsverteilung für Stickstoff (N2) bei drei verschiedenen Temperaturen abgebildet. Es ist auch die wahrscheinlichste Geschwindigkeit und die mittlere Geschwindigkeit eingezeichnet. Dabei gilt immer, dass die wahrscheinlichste Geschwindigkeit kleiner als die mittlere Geschwindigkeit ist. Allgemein gilt:
Der Zusammenhang zwischen den Geschwindigkeiten ergibt sich dabei aus:
| nach↓ \ von→ | ||||
|---|---|---|---|---|
| 1 | 0,886 | 0,816 | 1,128 | |
| 1,128 | 1 | 0,921 | 1,273 | |
| 1,225 | 1,085 | 1 | 1,382 | |
| 0,886 | 0,785 | 0,724 | 1 |
| T \ v | ||||
|---|---|---|---|---|
| 100 K (−173,15 °C) | 243,15 m/s | 274,36 m/s | 297,79 m/s | 215,43 m/s |
| 300 K (26,85 °C) | 421,15 m/s | 475,20 m/s | 515,78 m/s | 373,14 m/s |
| 800 K (526,85 °C) | 687,74 m/s | 776,02 m/s | 842,29 m/s | 609,34 m/s |
| nach↓ \ von→ | ||||
|---|---|---|---|---|
| 1 | ||||
| 1 | ||||
| 1 | ||||
| 1 | ||||
Herleitung im kanonischen Ensemble
Die Maxwell-Boltzmann-Verteilung lässt sich mit den Methoden der statistischen Physik herleiten. Man betrachtet ein -Teilchensystem mit der Hamilton-Funktion
Zur Herleitung wird nur die Annahme gemacht, dass das Potential konservativ, also von den unabhängig ist. Daher gilt die folgende Herleitung auch für reale Gase.
Das System befinde sich im kanonischen Zustand mit der Phasenraumdichte
und der kanonischen Zustandssumme
- mit
Der Parameter ist proportional zur inversen Temperatur
Der Erwartungswert einer klassischen Observablen ist gegeben durch
Für die Transformation von Wahrscheinlichkeitsdichten gilt: Gegeben sei eine Zufallsvariable und eine Wahrscheinlichkeitsdichte und eine Abbildung . Dann ist die Wahrscheinlichkeitsdichte der Zufallsvariablen .
Nun können wir die Wahrscheinlichkeitsdichte für den Impuls irgendeines Teilchens des Systems berechnen. Nach obigem Transformationssatz gilt:
Alle Orts-Integrationen lassen sich kürzen, sowie alle Impuls-Integrationen für . Somit bleibt nur noch die -Integration übrig.
Zur Auswertung dieses Ausdrucks nutzt man im Zähler die Faltungseigenschaft der Delta-Distribution
Im Nenner integriert man über eine Gauß-Funktion; die Integration in drei Dimensionen lässt sich auf ein eindimensionales Integral zurückführen mit
Man erhält die Wahrscheinlichkeitsdichte für den Impuls irgendeines Teilchens:
Der Vorfaktor entspricht im Wesentlichen der thermischen De-Broglie-Wellenlänge .
Damit lässt sich die Wahrscheinlichkeitsdichte für den Geschwindigkeitsbetrag mit dem Transformationssatz ermitteln
Die Integration führt man in Kugelkoordinaten durch und verwendet die Beziehung
Nun ist wieder die Faltungseigenschaft der Delta-Distribution zu verwenden
dabei ist die Heaviside-Sprungfunktion, die die Wahrscheinlichkeit für negative Betragsgeschwindigkeiten verschwinden lässt.
Setzt man für kommt man zur Maxwell-Boltzmann-Verteilung
Siehe auch
Einzelnachweise
- ↑ Klaus Stierstadt, Günther Fischer: Thermodynamik: Von der Mikrophysik zur Makrophysik (Kap. 6.7). Springer, Berlin, New York 2010, ISBN 978-3-642-05097-8 (eingeschränkte Vorschau in der Google-Buchsuche).
Weblinks
Auf dieser Seite verwendete Medien
In diesem Diagramm ist die Maxwell-Boltzmannsche Geschwindigkeitsverteilung für Stickstoff (N2) bei drei verschiedenen Temperaturen angegeben. Es ist auch die wahrscheinlichste Geschwindigkeit und die mittlere Geschwindigkeit eingezeichnet. Dabei gilt immer dass die wahrscheinlichste Geschwindigkeit kleiner als die mittlere Geschwindigkeit ist.




