Lithiumborhydrid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
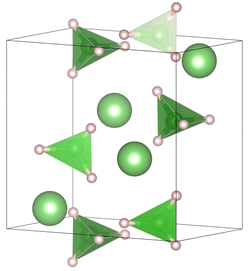 | ||||||||||||||||
| _ Li+ _ H _ B3+ | ||||||||||||||||
| Kristallsystem | orthorhombisch | |||||||||||||||
| Raumgruppe | Pnma (Nr. 62) | |||||||||||||||
| Gitterparameter | a = 7,17858(4) Å, b = 4,43686(2) Å, c = 6,80321(4) Å[1] | |||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lithiumborhydrid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | LiBH4 | |||||||||||||||
| Kurzbeschreibung | hygroskopischer hellgrauer Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 21,78 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[2] | |||||||||||||||
| Dichte | 0,6660 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | 280 °C[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Lithiumborhydrid ist eine chemische Verbindung aus der Gruppe der Lithiumverbindungen und Borane.
Gewinnung und Darstellung
Lithiumborhydrid kann durch eine Metathese-Reaktion von Natriumborhydrid und Lithiumbromid erzeugt werden.[4]
Die direkte Bildung aus metallischem Lithium, Bor und Wasserstoff ist im Prinzip möglich, erfordert aber extreme Bedingungen (150 at Wasserstoffdruck, 650 °C).[5]
Auch die Herstellung aus (intermediärem) Diboran (zum Beispiel aus Lithiumhydrid mit Bortrifluorid in Diethylether) ist möglich.[5][3]
Eigenschaften
Lithiumborhydrid ist ein brennbarer, hygroskopischer, weißer bis grauer Feststoff. Er zersetzt sich bei Kontakt mit Wasser oder feuchter Luft und bildet dabei Wasserstoff.[2]
Die Verbindung kristallisiert bei Raumtemperatur in der Raumgruppe Pnma (Raumgruppen-Nr. 62) mit den Gitterkonstanten a = 7,17858(4) Å, b = 4,43686(2) Å, c = 6,80321(4) Å in einer orthorhombischen verzerrten Wurtzit-Struktur. Bei höheren Temperaturen liegt eine hexagonale Kristallstruktur in der Raumgruppe P63mc (Raumgruppen-Nr. 186) mit den Gitterkonstanten a = 4,27631(5) Å, c = 6,94844(8) Å vor.[1]
Verwendung
Lithiumborhydrid wird als Reduktionsmittel für Aldehyde, Ketone, Lactone, Epoxide und Ester in der organischen Chemie verwendet.[2]
Einzelnachweise
- ↑ a b J-Ph. Soulie, G. Renaudin, R. Cerny, K. Yvon: Lithium boro-hydride LiBH4: I. Crystal structure. In: Journal of Alloys and Compounds. Band 346, Nr. 1–², 18. November 2002, S. 200–205, doi:10.1016/S0925-8388(02)00521-2.
- ↑ a b c d e f g h i Eintrag zu Lithiumborhydrid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 793.
- ↑ Peter Rittmeyer, Ulrich Wietelmann: Hydrides. In Ullmann's Encyclopedia of Industrial Chemistry. 2002, Wiley-VCH, Weinheim, doi:10.1002/14356007.a13_199.
- ↑ a b Patentanmeldung DE10302262A1: Verfahren zur Herstellung von Lithiumborhydrid. Angemeldet am 22. Januar 2003, veröffentlicht am 5. August 2004, Anmelder: Chemetall GmbH, Erfinder: Dieter Hauk, Ulrich Wietelmann.
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Autor/Urheber: Speedpera, Lizenz: CC BY 4.0
Kristallstruktur von Lithiumborhydrid (LiBH4) bei Raumtemperatur. Erstellt mit VESTA. Quelle der Kristallstruktur: J-Ph. Soulie, G. Renaudin, R. Cerny, K. Yvon (November 2002). Journal of Alloys and Compounds 346 (1–2): 200–205. DOI:10.1016/S0925-8388(02)00521-2. Laut Paper ist die Struktur ein orthorhombisch-verzerrter Wurtzit-Typ.
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien






