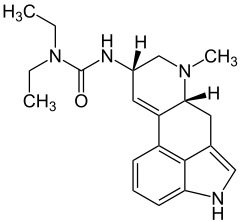
Lisurid
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Lisurid | |||||||||||||||
| Andere Namen | 1,1-Diethyl-3-(9,10-didehydro-6-methyl-8α-ergolinyl)harnstoff | |||||||||||||||
| Summenformel |
| |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Lisurid ist ein Arzneistoff, der in der Therapie des Morbus Parkinson, in der Prophylaxe der Migräne und als Prolaktinhemmer zum Abstillen eingesetzt wurde. Lisurid wurde in Deutschland unter dem Markennamen Dopergin vertrieben und unterlag der ärztlichen Verschreibungspflicht.
Chemie
Lisurid ist ein von Mutterkornalkaloiden abgeleiteter Arzneistoff mit einem Ergolingrundgerüst. Es unterscheidet sich jedoch von natürlich vorkommenden Ergolinen, wie z. B. Ergotamin, durch eine (8S)-Konfiguration im Ergolingrundgerüst.
Mit Tergurid und Mesulergin sind zwei strukturell verwandte Verbindungen des Lisurids bekannt, die klinisch erprobt wurden.
Die Darstellung von Lisurid erfolgt durch einen Hofmann-, Curtius- oder Lossen-Abbau von Lysergsäure, anschließender Racemattrennung und Acylierung der (8S)-Aminogruppe mit Diethylcarbamoylchlorid.
Pharmakologie
Anwendungsgebiete
Lisurid wurde als Migräneprophylaktikum entwickelt. Für diese Indikation besteht in Deutschland keine Zulassung mehr. Lisurid wurde bis Juli 2016 primär in Kombination mit Levodopa bei Patienten mit Morbus Parkinson eingesetzt. Weitere Anwendungsgebiete waren Restless-Legs-Syndrom, Malignes Neuroleptika-Syndrom[4], primäres und sekundäres Abstillen, Galaktorrhoe, prolaktinbedingte Amenorrhoe sowie Akromegalie.
Wirkmechanismus
Lisurid gilt wie viele Ergoline als ein „Dirty Drug“, da es mit vielen Rezeptoren, darunter Dopaminrezeptoren, Serotoninrezeptoren und Adrenozeptoren interagiert. Im Gegensatz zu allen anderen therapeutisch eingesetzten Mutterkornalkaloidderivaten zeigt Lisurid zusätzlich eine hohe Affinität zu Histaminrezeptoren und Beta-Adrenozeptoren.[5]
Für seine klinische Wirksamkeit in der Therapie der Parkinson-Krankheit wird eine Interaktion mit Dopaminrezeptoren verantwortlich gemacht. Dabei wirkt Lisurid als Partialagonist (Dopaminagonist) an den Dopaminrezeptoren der Subtypen D2/3/4 und ferner auch der Subtypen D1/5[5] und kann somit die Dopaminmangelsymptome des Morbus Parkinson beseitigen. Darüber hinaus führt eine Lisurid-induzierte Stimulation von Dopamin-Rezeptoren der Hypophyse zu einer Hemmung der Freisetzung des Hormons Prolactin und somit zu einer Hemmung der Milchproduktion.
An Serotoninrezeptoren des Subtyps 5-HT2B wirkt Lisurid als Antagonist.[6] Mit einer Hemmung dieser Rezeptoren wird seine Wirksamkeit in der Migräneprophylaxe in Verbindung gebracht.[7] An den Serotoninrezeptoren des Subtyps 5-HT1A[8] und 5-HT2A/C[9] wirkt es als Partialagonist. Zu den Serotoninrezeptoren des Subtyps 5-HT1B/D ist Lisurid ebenso affin, ob es dabei als Agonist oder Antagonist wirkt, ist nicht geklärt.[10]
Nebenwirkungen
Besonders am Anfang der Therapie, bei zu hoher Dosierung oder Dosissteigerung oder bei Einnahme ohne gleichzeitige Mahlzeit können Übelkeit, Müdigkeit, Benommenheit, Schwindelgefühl, Kopfschmerzen, Schwitzen, Mundtrockenheit und plötzlicher Blutdruckabfall sowie in seltenen Fällen Erbrechen und auch Retroperitonealfibrosen auftreten.
Im Tierversuch löst Lisurid bei männlichen Ratten eine vorzeitige Ejakulation aus.[11][12] Bei weiblichen sowie bei frühkastrierten männlichen Ratten führt die Gabe von Lisurid kurz nach der Geburt oder während der Pubertät zur Ausbildung männlicher Verhaltensmuster.[13]
Wechselwirkungen
Die sedierende Wirkung des Präparates kann durch andere, auf das zentrale Nervensystem dämpfend wirkende Arzneimittel verstärkt werden. Bei gleichzeitiger Anwendung mit Neuroleptika und anderen Dopaminantagonisten ist eine wechselseitige Wirkungsabschwächung zu erwarten.
Handelsnamen
Lisurid war in Deutschland und Österreich unter dem Namen Dopergin bis Juli 2016 im Handel erhältlich.[14]
Einzelnachweise
- ↑ a b The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, 14. Auflage (Merck & Co., Inc.), Whitehouse Station, NJ, USA, 2006; S. 956–957, ISBN 978-0-911910-00-1.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Lisuride im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Juni 2020.
- ↑ a b c Eintrag zu Lisuride maleate in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM), abgerufen am 10. Juni 2020. (Seite nicht mehr abrufbar)
- ↑ Hans-Jörg Assion: Malignes neuroleptisches Syndrom. Georg Thieme Verlag, 2004, ISBN 978-3-131-33171-7, S. 33 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Millan, M.J. et al. (2002): Differential actions of antiparkinson agents at multiple classes of monoaminergic receptor. I. A multivariate analysis of the binding profiles of 14 drugs at 21 native and cloned human receptor subtypes. In: J Pharmacol Exp Ther., 303(2), 791–804; PMID 12388666; PDF (freier Volltextzugriff, engl.).
- ↑ Jähnichen S, Horowski R, Pertz HH: Agonism at 5-HT2B receptors is not a class effect of the ergolines. In: Eur. J. Pharmacol. 513. Jahrgang, Nr. 3, April 2005, S. 225–8, doi:10.1016/j.ejphar.2005.03.010, PMID 15862804.
- ↑ Schmuck K, Ullmer C, Kalkman HO, Probst A, Lubbert H: Activation of meningeal 5-HT2B receptors: an early step in the generation of migraine headache? In: The European Journal of Neuroscience. 8. Jahrgang, Nr. 5, Mai 1996, S. 959–67, doi:10.1111/j.1460-9568.1996.tb01583.x, PMID 8743744.
- ↑ Marona-Lewicka D, Kurrasch-Orbaugh DM, Selken JR, Cumbay MG, Lisnicchia JG, Nichols DE: Re-evaluation of lisuride pharmacology: 5-hydroxytryptamine1A receptor-mediated behavioral effects overlap its other properties in rats. In: Psychopharmacology (Berl.). 164. Jahrgang, Nr. 1, Oktober 2002, S. 93–107, doi:10.1007/s00213-002-1141-z, PMID 12373423.
- ↑ Egan CT, Herrick-Davis K, Miller K, Glennon RA, Teitler M: Agonist activity of LSD and lisuride at cloned 5HT2A and 5HT2C receptors. In: Psychopharmacology (Berl.). 136. Jahrgang, Nr. 4, April 1998, S. 409–14, doi:10.1007/s002130050585, PMID 9600588.
- ↑ Mark J. Millan, Lisa Maiofiss, Didier Cussac, Valerie Audinot, Jean-A. Boutin, Adrian Newman-Tancredi: Differential actions of antiparkinson agents at multiple classes of monoaminergic receptor. I. A multivariate analysis of the binding profiles of 14 drugs at 21 native and cloned human receptor subtypes. In: The Journal of pharmacology and experimental therapeutics. 303. Jahrgang, Nr. 2, November 2002, S. 791–804, doi:10.1124/jpet.102.039867, PMID 12388666.
- ↑ L. Napoli-Farris, W. Fratta, G. L. Gessa: Stimulation of dopamine autoreceptors elicits "premature ejaculation" in rats. In: Pharmacology, Biochemistry and Behavior. Band 20, Nummer 1, Januar 1984, S. 69–72, PMID 6695002.
- ↑ Z. Hlinák, J. Madlafousek, I. Krejcí: Effects of lisuride on precopulatory and copulatory behaviour of adult male rats. In: Psychopharmacology. Band 79, Nummer 2–3, 1983, S. 231–235, PMID 6405433.
- ↑ F. Götz, R. Tönjes, J. Maywald, G. Dörner: Short- and long-term effects of a dopamine agonist (lisuride) on sex-specific behavioural patterns in rats. In: Experimental and clinical endocrinology. Band 98, Nummer 2, 1991, S. 111–121, doi:10.1055/s-0029-1211107. PMID 1778225.
- ↑ Patrick Hollstein: Vergessene Klassiker, erloschene Zulassungen. Apotheke-Adhoc.de, 29. Juni 2016.
Auf dieser Seite verwendete Medien
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Lisurid_Strukturformel

