Lipidsenker

Lipidsenker sind eine Gruppe von Wirkstoffen, die erhöhte Lipidkonzentrationen im Blut (Hyperlipidämie) senken. Sie werden therapeutisch zur Behandlung krankhaft erhöhter Werte eingesetzt, wenn andere Maßnahmen (Diät, sportliche Betätigung) nicht angezeigt oder nicht ausreichend wirksam sind. Bei einer Hyperlipidämie sind die Blutkonzentrationen von Cholesterol (Cholesterin) und/oder Triglyceriden erhöht, was als Risikofaktor für das Entstehen von Arteriosklerose gilt. In der Folge kann es zu Schlaganfall, Herzinfarkt und arterieller Verschlusskrankheit kommen.
Lipidsenker stellen weltweit ein umsatzstarkes Segment im Pharmamarkt dar. Der 1996 eingeführte Cholesterolsenker Atorvastatin (Lipitor, Sortis) des US-Herstellers Pfizer zählte bis 2017 mit einem Gesamtumsatz von 142 Milliarden US-Dollar zum umsatzstärksten Medikament weltweit.
Einteilung
Lipidsenker können die Wirkung lokal oder systemisch entfalten und unterschiedlich ausgeprägt auf Cholesterin (Cholesterinsenker) oder Triglyceride wirken.
Statine

Statine (CSE-Hemmer) hemmen kompetitiv die HMG-CoA-Reduktase, ein Schlüsselenzym der Biosynthese von Cholesterol. Auch erhöhte Triglyderidkonzentrationen werden durch Statine reduziert. Als erster Vertreter wurde 1987 in den USA das Lovastatin eingeführt, das auch natürlich in bestimmten Schimmelpilzen vorkommt („Monacoline“). Statine haben eine breite Verwendung und sind vielfach die Mittel der Wahl. Weitere Vertreter sind Atorvastatin, Fluvastatin, Pitavastatin, Pravastatin, Rosuvastatin und Simvastatin. Das 1997 eingeführte Cerivastatin wurde wegen teilweise tödlichen Wechselwirkungen mit Gemfibrozil 2001 weltweit vom Markt genommen.
Fibrate

Clofibrinsäure und ihre Abkömmlinge bzw. Analoga (Fibrate) senken hauptsächlich die Triglyceride. Die Substanzen bewirken einen gesteigerten Fettsäureabbau in Peroxisomen, indem sie die intrazellulären Peroxisom-Proliferator-aktivierten Rezeptoren (PPARα) aktivieren. Es resultiert darüber hinaus auch eine geringfügige Abnahme des LDL-Cholesterols und eine Zunahme des „guten“ HDL-Cholesterols. Clofibrat (Ethylester der Clofibrinsäure) wurde seit den 1960er Jahren therapeutisch eingesetzt.[1] Weitere Vertreter sind Bezafibrat, Etofibrat, Fenofibrat und Gemfibrozil. Mit dem Aufkommen der Statine hat die Bedeutung der Fibrate abgenommen.
Ein Vertreter einer neuen Fibrat-Generation ist der hoch selektive PPARα-Modulator (SPPARM) Pemafibrat. In Japan ist das Mittel seit 2017 zur Behandlung der Hyperlipidämie zugelassen.[2]
Ionenaustauscher
Basische Anionenaustauscher wie Colestyramin und Colesevelam wirken im Magen-Darm-Trakt lokal als Gallensäurebinder. Die wasserunlöslichen und nicht resorbierbaren Harze adsorbieren – im Austausch gegen Chlorid – Gallensäuren, die dann mit den Fäzes ausgeschieden werden und dem enterohepatischen Kreislauf entzogen werden. Sie sind somit für die Cholesterolbiosynthese in der Leber nicht mehr verfügbar. Gallensäurebinder gehören zu den ältesten lipidsenkenden Arzneimitteln. Nachteilig sind der schlechte Geschmack der in Gramm-Mengen einzunehmenden Mengen sowie die Nebenwirkungen auf den Magen-Darm-Trakt. Colestipol ist in Deutschland nicht mehr auf dem Markt.[3] Es wurde international auch unter den Handelsnamen Colestid und Cholestabyl vertrieben.
Nicotinsäure
Nicotinsäure senkt sowohl die Cholesterol- als auch die Triglyceridspiegel im Plasma. Die Wirkung entsteht durch Hemmung der Triglyceridlipase, infolge derer die VLDL-Biosynthese in der Leber abnimmt und die LDL-Cholersterolspiegel erniedrigt sind.[4] Aufgrund der Verfügbarkeit von Wirkstoffen mit günstigerem Nutzen-Risiko-Profil haben Nicotinsäure und ihre Analoga/Derivate (z. B. Nicotinylalkohol, Acipimox) kaum mehr therapeutische Bedeutung.
PCSK9-Hemmer
PCSK9-Hemmer sind eine vergleichsweise neue Stoffgruppe. Die Wirkung beruht auf der Hemmung der Proproteinkonvertase PCSK9, einem Enzym, das den LDL-Cholesterolspiegel reguliert. Zur Gruppe gehören die 2015 zugelassenen monoklonalen Antikörper Alirocumab und Evolocumab, die Entwicklung von Bococizumab wurde 2016[5] eingestellt. Die Antikörper blockieren die Bindung der PCSK9 an die LDL-Rezeptoren, wodurch sich die Zahl der LDL-Rezeptoren an der Zellmembran erhöht. Entsprechend wird der Abbau von LDL-Cholesterol über diese Rezeptoren gesteigert, es resultiert eine erhebliche Senkung des LDL-Cholesterolspiegels im Blut.
Ebenfalls an der PCSK9, aber über einen anderen Mechanismus, setzt die Wirkung von Inclisiran an. Der Arzneistoff ist ein Konjugat aus einer verzweigten N-Acetylgalactosamin-Verbindung und einer doppelsträngigen kleinen interferierenden Ribonukleinsäure (siRNA), welches nach Aufnahme in die Hepatozyten über den Mechanismus der RNA-Interferenz den katalytischen Abbau der mRNA für das Enzym PCSK9 steuert. Danach kommt es – wie bei den Antikörperwirkstoffen – zur Erhöhung der LDL-Rezeptoren auf der Oberfläche der Hepatozyten, LDL-Cholesterol wird vermehrt abgebaut, so dass die Blutspiegel absinken. Das 2020 zugelassene Medikament wird subkutan gespritzt und braucht nur halbjährlich verabreicht werden.[6]
Cholesterol-Resorptionshemmer
Ein weiteres Therapiekonzept stellt die Hemmung der Acetyl-CoA-Acetyltransferase (ACAT) dar. Das Enzym ACAT wirkt bei der Veresterung des Cholesterols im Rahmen der intrazellularen Cholesterolhomöostase und der Cholesterol-Resorption aus dem intestinalen Lumen. Durch Hemmung der ACAT soll die Bildung von Cholesterolestern verringert und zudem die Ablagerung in Makrophagen unterdrückt werden. Die Entwicklung des ACAT-Inhibitors Pactimib wurde 2006 aufgegeben.[7] Auch Lecimibid ist ein Vertreter der ACAT-Inhibitoren, ebenso Eflucimib und Avasimib, die – wie noch weitere Substanzen – in den 1990er und 2000er-Jahren untersucht wurden.[8]
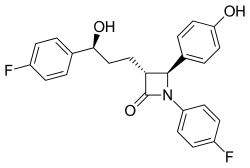
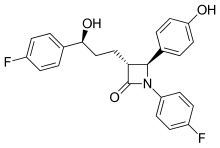
Im Zuge der ACAT-Forschung wurde das Konzept der Hemmung von NPC1L1 (Niemann-Pick-C1-like-1-Protein) entwickelt. Aus dem zunächst entwickelten Prototyp SCH-48461 entstand als bislang einziger therapeutisch genutzter Vertreter der NPC1L1-Hemmer das 2002 eingeführte Ezetimib.[9]
ACL-Hemmer
Hemmung der ATP-Citrat-Lyase (ACL) ist ein neueres Therapieprinzip. Die 2020 zugelassene Bempedoinsäure wird im Körper in die aktive Form Bempedoyl-CoA umgewandelt, die das in der Cholesterol-Biosynthese wirksame Enzym ACL hemmt. Dadurch kommt es zu einer verminderten intrazellulären Cholesterol-Bildung, die zur Hochregulation von LDL-Rezeptoren führt. Sie nehmen mehr LDL-Partikel auf und die Plasmakonzentration des LDL-Cholesterols sinkt. Die Aktivierung der Bempedoinsäure erfolgt nur in der Leber, nicht in den Skelettmuskelzellen. Es kommt nicht zu muskelbezogenen Nebenwirkungen wie bei den Statinen. Anders als die Statine bewirkt Bempedoyl-CoA zudem eine Verminderung der Triglyceridspiegel im Blut durch die Hemmung der Biosynthese von Fettsäuren.[10]
CETP-Hemmer
Das Cholesterinester-Transferprotein (CETP) ist eines von mehreren Proteinen, die am Cholesterintransport zwischen unterschiedlichen Lipoprotein-Fraktionen beteiligt sind. Durch Hemmung oder Modulation des Proteins lässt sich die HDL-Fraktion des Gesamtcholesterols anheben, bei gleichzeitiger Absenkung der LDL-Werte. Der erste Vertreter der CETP-Hemmer Torcetrapib konnte die Erwartungen an den klinischen Nutzen nicht erfüllen,[11] die Entwicklung wurde 2006 eingestellt. Auch weitere Vertreter (Dalcetrapib, Evacetrapib, Obicetrapib, Anacetrapib) haben keine Marktreife erreicht (Stand 2021).
Sonstige

β-Sitosterol ist ein überwiegender Bestandteil der natürlich vorkommenden Phytosterole. Die Substanz hemmt kompetitiv die Resorption von Cholesterol und führt dadurch zu einer vermehrten Cholesterolausscheidung mit dem Stuhl. Durch Verminderung des LDL-Cholesterols werden erhöhte Serumcholesterolspiegel gesenkt. Die Wirkung ist mäßig, es sind Dosen im Grammbereich erforderlich.[4] Die den LDL-Cholesterolspiegel absenkende Wirkung ist seit den späten 1950er Jahren aus zahlreichen Studien an mit Phytosterolen angereicherten Lebensmitteln bekannt.[12]
Ethylester von mehrfach ungesättigten Omega-3-Fettsäuren wie etwa das teilsynthetisch aus Fischöl hergestellte Omega-3-Säurenethylester 90 fungieren als falsche Substrate in der Synthese der triglyceridreichen Lipoproteine (VLDL, very low density Lipoproteine) in der Leber. Omega-3-Fettsäuren greifen auch auf weitere Weisen ein in die Prozesse, die für die Arteriosklerose-Entstehung von Bedeutung sind.[13] Zu der Stoffgruppe zählt auch das Icosapent-Ethyl, das in der Zusatzbehandlung bei mit Statinen behandelten erwachsenen Patienten mit hohem kardiovaskulärem Risiko zur Anwendung kommt.
Neue Therapieprinzipien:
- Mipomersen ist ein Antisense-Oligonukleotid (ASO), das eine verminderte Bildung von Apolipoprotein B (ApoB) bewirkt. ApoB ist der Hauptbestandteil des LDL-Cholesterins und zweier eng verwandter Fraktionen, IDL- und VLDL-Cholesterin. Die homozygote familiäre Hypercholesterinämie (HoFH) ist eine genetisch bedingte Fettstoffwechselstörung, die durch hohe Blutspiegel von IDL- und VLDL-Cholesterin gekennzeichnet ist. Das Risiko für eine koronare Herzkrankheit ist dadurch erhöht. Mipomersen wirkt dem entgegen und wurde 2013 für diese Anwendung in den USA zugelassen. Für die EU wurde die Zulassung versagt.
- Ein weiteres Antisense-Oligonukleotid ist das Volanesorsen, das seit 2019 in der EU 2019 zur unterstützenden Behandlung der familiären Chylomikronämie (familial chylomicronemia syndrome, FCS) zugelassen ist.
- Lomitapid ist der erste Vertreter der neuen Wirkstoffklasse von Inhibitoren des mikrosomalen Triglycerid-Transfer-Proteins (MTP). MTP kommt im Lumen des endoplasmatischen Retikulums in Leber und Darm vor und ist für die Bindung und den Transport einzelner Lipidmoleküle zwischen Membranen verantwortlich. Das 2012 erstmals in den USA zugelassene Mittel ist angezeigt zur Behandlung der seltenen homozygoten familiären Hypercholesterinämie (HoFH) in Kombination mit anderen Maßnahmen und durch einen in der Behandlung von Lipidstörungen erfahrenen Arzt und unter entsprechender Überwachung.
- Alipogentiparvovec ist ein 2012 zugelassener gentherapeutischer Wirkstoff. Er kam zum Einsatz in der Behandlung des familiären Lipoproteinlipase-Mangels (Hyperchylomikronämie). Die genetisch bedingte Unfähigkeit, Lipoproteinlipase zu bilden wird korrigiert dadurch, dass die Muskelfaserzellen (Myozyten) in die Lage versetzt werden, das Enzym zu produzieren. 2017 nahm der Hersteller das Mittel vom Markt, nachdem er sich gegen die Verlängerung der Zulassung entschieden hatte, die durch Zeitablauf erlosch.[14]
- Der monoklonale Antikörper Evinacumab wurde 2021 als erster Vertreter der ANGPTL3-Inhibitoren zugelassen zur Behandlung der homozygoten familiären Hypercholesterinämie (HoFH). Die Wirkung beruht auf einer von den LDL-Rezeptoren unabhängigen Senkung des LDL-Cholesterols.

Markt
Cholesterinsenker stellen ein weltweit umsatzstarkes Segment des Pharmamarktes dar. Im Jahr 2004 wurden mit Cholesterinsenkern weltweit Umsätze von 27 Milliarden US-Dollar erzielt, bei einer Wachstumsrate von 10,9 %.
Weltweit nehmen etwa 25 Millionen Menschen regelmäßig cholesterinsenkende Präparate ein (Stand 2006).
Lipitor
Der 1996 eingeführte Lipidsenker Atorvastatin (Lipitor, Sortis) des US-Herstellers Pfizer zählte bis 2017 mit einem Gesamtumsatz von 142 Milliarden US-Dollar zum umsatzstärksten Medikament weltweit.[18] 2003 war Lipitor mit einem Anteil von etwa 50 Prozent in den USA Marktführer in der Kategorie der Cholesterinsenker. Mit rund 30 Prozent Marktanteil folgte das Mittel Zocor (Simvastatin) des Wettbewerbers Merck & Co.[19] Im Jahr 2005 erzielte Lipitor einen Umsatz von weltweit 12,2 Milliarden US-Dollar.[20] Nach dem Verlust des Patentschutzes (November 2011 in USA, Mitte 2012 in Europa) brachen die Umsätze ein.[21] Im Jahr 2019 belief sich Pfizers Umsatz mit Lipitor auf rund 1,97 Milliarden US-Dollar.[22]
Deutschland
Der Markt der Lipidsenker wächst in Deutschland seit Jahren stetig. Wie der «Arzneiverordnungs-Report 2003» informierte, machten seit Mitte der 1990er Jahre die Statine die größte Gruppe der im GKV-Bereich verordneten Lipidsenker aus. Die Bedeutung der Fibrate sei nur noch gering.[23] Auch 2019 bilden die Statine, bei weiterem Rückgang der Fibrate, die größte Gruppe. Ergänzt wird das Spektrum der Verordnungen inzwischen um das 2002 eingeführte Ezetimib (seit 2018 preisgünstig generisch verfügbar[24]), die auf niedrigen Niveau ebenfalls steigen.[24] Im Jahr 2019 überholte Atorvastatin erstmals Simvastatin, das bis dahin lange Zeit die Wirkstoffgruppe anführte.[24] Auch die Verordnungen für die PCSK9-Inhibitoren stiegen deutlich. Ihr Einsatz ist jedoch im GKV-Bereich seit 2016 durch eine Verordnungsbeschränkung des Gemeinsamen Bundesausschusses (G-BA) nur erstattungsfähig für bestimmte Hochrisikopatienten, wenn andere Optionen zur Lipidsenkung ausgeschöpft sind bzw. eine LDL-Apherese angezeigt wäre.[25]
| Jahr | Rang[27] nach Umsatzstärke | Nettokosten (Mio. €) | Verordnungen (Mio.) | DDD (Mio.)[28] |
|---|---|---|---|---|
| 2019 | 13 | 737,4 | 25,2 | 2741,8 |
| 2018 | 13 | 708,8 | 23,0 | 2436,9 |
| 2017 | 14 | 673,1 | 22,4 | 2305,0 |
| 2016 | 17 | 606,8 | 21,8 | 2190,2 |
| 2015 | 19 | 542,8 | 20,7 | 2047,1 |
| 2014 | 14 | 533,4 | 20,2 | 1960,4 |
| 2013 | 14 | 532,8 | 19,5 | 1861,3 |
| 2012 | 13 | 574,1 | 19,3 | 1793,7 |
| 2011 | 13 | 603,6 | 18,8 | 1720,7 |
| 2010 | 1647 | |||
| 2009 | 1585 | |||
| 2008 | 15 | 735,5 | 16,9 | 1471 |
| 2007 | 16 | 720,1 | 15,0 | 1291 |
| 2006 | 16 | 786,0 | 14,1 | 1159 |
| 2005 | 978 | |||
| 2004 | 856 | |||
| 2003 | 791 |
Literatur
- G. Geisslinger, S. Menzel, T. Gudermann, B. Hinz, P. Ruth: Mutschler Arzneimittelwirkungen. Pharmakologie – Klinische Pharmakologie – Toxikologie. Begründet von Ernst Mutschler, 11. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2020, ISBN 978-3-8047-3663-4. S. 396 ff.
Einzelnachweise
- ↑ J.C. Daubresse, D. Daigneux, M. Bruwier, A. Luyckx, and P.J. Lefebvre: Clofibrate and diabetes control in patients treated with oral hypoglycaemic agents. In: British Journal of Clinical Pharmacology. Band 7, 1979, S. 599–603, doi:10.1111/j.1365-2125.1979.tb04649.x.
- ↑ S. Yamashita, D. Masuda, Y. Matsuzawa: Pemafibrate, a New Selective PPARα Modulator: Drug Concept and Its Clinical Applications for Dyslipidemia and Metabolic Diseases. In: Current Atherosclerosis Reports. Band 22, 2020, doi:10.1007/s11883-020-0823-5.
- ↑ Neuer Anionenaustauscher Colesevelam. In: arznei-telegramm. Band 5, 2008, S. 57 (arznei-telegramm.de).
- ↑ a b Ernst Mutschler: Arzneimittelwirkungen. 7. Auflage 1996, WVG Stuttgart, ISBN 3-8047-1377-7; S. 431 ff.
- ↑ Pfizer Discontinues Global Development of Bococizumab, Its Investigational PCSK9 Inhibitor, PM Pfizer vom 1. November 2016, abgerufen am 25. Januar 2021.
- ↑ L. Naßwetter: Cholesterinsenkung bald halbjährlich statt täglich? In: DAZ.online. August 2020 (deutsche-apotheker-zeitung.de).
- ↑ N.N.: Atherosklerose: Rückschlag für ACAT-Inhibitoren. In: Deutsche Apothekerzeitung. Nr. 27, 2006, S. 36 (deutsche-apotheker-zeitung.de).
- ↑ A. J. López-Farré, D. Sacristán, J.J. Zamorano-León, N. San-Martín, C. Macaya: Inhibition of Acyl-CoA Cholesterol Acyltransferase by F12511 (Eflucimibe): Could it be a New Antiatherosclerotic Therapeutic? In: Cardiovascular Therapeutics. 2008, doi:10.1111/j.1527-3466.2007.00030.x.
- ↑ J. Fischer, C. R. Ganellin: Analogue-based Drug Discovery II, John Wiley & Sons, 2010. S. 42 f. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ Assessment report. (pdf) Europäische Arzneimittel-Agentur, 30. Januar 2020, abgerufen am 15. Januar 2021 (englisch).
- ↑ N.N.: CETP-Hemmung – ein neuer Therapieansatz. In: Deutsche Apothekerzeitung. Nr. 27, 2008, S. 51 (deutsche-apotheker-zeitung.de).
- ↑ C.E. Cabral1, M.R. Simas Torres Klein: Phytosterols in the Treatment of Hypercholesterolemia and Prevention of Cardiovascular Diseases. In: Arquivos Brasileiros de Cardiologia. Band 109, Nr. 5, 2017, S. 475–482, doi:10.5935/abc.20170158.
- ↑ W. O. Richter, S. Bertsch, S.-D. Müller: Omega-3-Fettsäuren. In: Deutsche Apothekerzeitung. Nr. 15, 2001, S. 43.
- ↑ Glybera – die erste Gentherapie scheiterte rasch. In: www.wissensschau.de. Abgerufen am 28. Januar 2021.
- ↑ Syed Mahmood, Daniel Levy, Ramachandran S. Vasan, Thomas J. Wang: The Framingham Heart Study and the epidemiology of cardiovascular disease: a historical perspective. In: The Lancet, 2014, Band 383, Nummer 9921, S. 999–1008 doi:10.1016/S0140-6736(13)61752-3.
- ↑ Thomas R. Dawber, Felix E. Moore, George K. I. Mann: II. Coronary Heart Disease in the Framingham Study. In: American Journal of Public Health (AJPH), 1957, Band 47, Nummer 4_Pt_2, S. 4–24. DOI:10.2105/ajph.47.4_pt_2.4.
- ↑ Scandinavian Simvastatin Survival Study Group: Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). In: The Lancet, 1994, Band 344, Nummer 8934 doi:10.1016/S0140-6736(94)90566-5.
- ↑ Patentierte Marktanteile – Die sechs umsatzstärksten Medikamente seit Markteinführung, www.euroforum.de, 26. Oktober 2018.
- ↑ Die umsatzstärkste Pille der Welt bekommt Konkurrenz, FAZ, 21. Juli 2003.
- ↑ Pfizer gets sued over Celebrex; 27. Februar 2006.
- ↑ Pfizer kämpft mit Umsatzeinbruch bei Lipitor®, DAZ.online, 30. April 2013.
- ↑ Rainer Radtke: Weltweiter Umsatz von Pfizer mit dem Medikament Lipitor in den Jahren 2003 bis 2019, veröffentlicht von Statista Research Department, 28. April 2020.
- ↑ Ulrich Schwabe, Dieter Paffrath: Arzneiverordnungs-Report 2003, Springer-Verlag, 2003. S. 570.
- ↑ a b c Ulrich Schwabe, Wolf-Dieter Ludwig: Arzneiverordnungs-Report 2020, Springer-Verlag, 2020. S. 601 f.
- ↑ Amgen erfreut über Verordnungausschluss, DAZ.online, 7. Juni 2016.
- ↑ Arzneiverordnungs-Report 2020 (S. 10), 2019 (S. 10), 2018 (S. 8), 2017 (S. 7), 2016 (S. 7), 2015 (S. 7), 2014 (S. 5), 2013 (S. 4), 2012 (S. 4), 2009 (S. 6), 2008 (S. 5), 2007 (S. 9).
- ↑ Rang innerhalb der umsatzstärksten Arzneimittelgruppen.
- ↑ Jahre 2011─2018: Arzneiverordnungs-Report. Jahre 2003─2010: Arzneimittel - Verbrauch von lipidsenkenden Mitteln in Deutschland 2003–2010. Veröffentlicht von Statista Research Department, 12. September 2012 [1].
Auf dieser Seite verwendete Medien
This is my own work. There is no identifying material to determine the person from which this blood came. The patient in question was in their thirties, and had been fasting for 36 hours. This is a standard EDTA (cell count) tube, as may be used to obtain a full blood count or iron studies. The tube was set upright for four hours - it was not centrifuged.
This sample was not analysed; however, a similar sample showed a serum triglyceride of over 130mmol/L (over 5000mg/dl), and an LDL over 40mmol/L (over 1540mg/dl).
If others would like to edit or modify this image I'd be pleased - I took this and uploaded it simply to give the hyperlipidaemia article some interest.
My name is Carmen Crisp-Obenhaus and this is my blood. It was taken after it was drawn in my phlebotomy class in 2010. I do have severe hyperlipidemia genetically. I was 33 years old at the time and have been on several medications.Skeletal formula of ezetimibe (trade names Zetia and Ezetrol) — a lipid-lowering agent (cholesterol absorption inhibitor).
1st generation statins
Autor/Urheber: Benff, Lizenz: CC BY-SA 4.0
Chronologie der Lipidsenker-Entwicklung (Stand 2023)
Strukturformel von Cholesterin
Structural formulas of fenofibrate, bezafibrate and gemfibrozil