Lawessons Reagenz
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
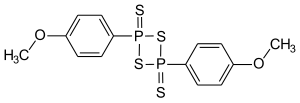 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Lawessons Reagenz | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C14H14O2P2S4 | ||||||||||||||||||
| Kurzbeschreibung | gelbes, übelriechendes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 404,47 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Lawessons Reagenz ist eine phosphor- und schwefelhaltige organische Verbindung und wurde nach seinem Entdecker, dem schwedischen Chemiker Sven-Olov Lawesson, benannt.
Herstellung
Lawessons Reagenz wird aus Phosphor(V)-sulfid und Anisol synthetisiert.[3]
Verwendung
Lawessons Reagenz hat sich als äußerst nützlich für die Herstellung von Thiocarbonylverbindungen aus Carbonylverbindungen erwiesen. Es ist reaktiver als Phosphor(V)-sulfid, P4S10, und bei höherer Temperatur ausreichend in organischen Lösungsmitteln löslich, so dass die Reaktionen in einer homogenen Lösung durchgeführt werden können. Lactame lassen sich mittels Lawessons Reagenz in Thiolactame umwandeln:[4] Ebenso lassen sich so Phosphinoxide in die entsprechenden Phosphinsulfide überführen, enantiomerenreine P-stereogene Verbindungen reagieren unter Retention der Konfiguration.[5]
Mechanismus
Das Reagenz steht im Gleichgewicht mit der monomeren Form. Diese reagiert in einem Mechanismus ähnlich dem der Wittig-Reaktion mit einer Carbonylverbindung.[6]
Siehe auch
- Catals Reagenz
- Woollins’ Reagenz
Einzelnachweise
- ↑ a b c Datenblatt Lawessons Reagenz bei Merck, abgerufen am 14. April 2005.
- ↑ a b Datenblatt Lawesson reagent bei Sigma-Aldrich, abgerufen am 7. April 2011 (PDF).
- ↑ Eintrag zu Lawessons Reagenz. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. September 2014.
- ↑ A. Padwa und M. D. Danca, Organic Letters 2002, 715.
- ↑ Małgorzata Kwiatkowska, Grzegorz Krasiński, Marek Cypryk, Tomasz Cierpiał, Piotr Kiełbasiński: Lipase-mediated stereoselective transformations of chiral organophosphorus P-boranes revisited: revision of the absolute configuration of alkoxy(hydroxymethyl)phenylphosphine P-boranes. In: Tetrahedron: Asymmetry. Band 22, Nr. 14–15, 31. Juli 2011, S. 1581–1590, doi:10.1016/j.tetasy.2011.08.024.
- ↑ Portal für organische Chemie.
Weblinks
- I. Thomsen, K. Clausen, S. Scheibye, and S.-O. Lawesson: Thiation with 2,4-Bis(4-Methoxyphenyl)-1,3,2,4-Dithiaphosphetane 2,4-Disulfide: N-Methylthiopyrrolidone In: Organic Syntheses. 62, 1984, S. 158, doi:10.15227/orgsyn.062.0158; Coll. Vol. 7, 1990, S. 372 (PDF).
Auf dieser Seite verwendete Medien
Strukturformel von Lawessons Reagenz
Autor/Urheber: Jürgen Martens, Lizenz: CC BY-SA 3.0
Thiolactame Synthesis with Lawesson's Reagent
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for flammable substances




