Kupfer(II)-nitrat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kupfer(II)-nitrat | ||||||||||||||||||
| Andere Namen | Kupferdinitrat | ||||||||||||||||||
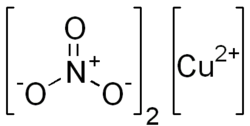
| Summenformel | Cu(NO3)2 | ||||||||||||||||||
| Kurzbeschreibung | blaugrünliche, zerfließliche Kristalle; als Hydrate tiefblau[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 187,55 g·mol−1 (wasserfrei) 241,60 g·mol−1 (Trihydrat) | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | gut in Wasser (1378 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Kupfer(II)-nitrat ist eine chemische Verbindung des Kupfers aus der Gruppe der Nitrate.
Gewinnung und Darstellung


Das Salz kann im Labor sehr einfach durch Einwirken von halbkonzentrierter Salpetersäure auf metallisches Kupfer gewonnen werden. Bei der Reaktion bildet sich am Kupfer gasförmiges Stickstoffmonoxid, während sich die Lösung mit zunehmender Salzkonzentration analog zum Kupfer(II)-chlorid von Blau nach Grün verfärbt.
Das farblose Stickstoffmonoxid reagiert sofort mit Luftsauerstoff zum rotbraunen Stickstoffdioxid weiter.
Eine weitere Methode ist, eine Kupfersulfat-Lösung mit Natronlauge zu mischen, wobei Kupferhydroxid entsteht. Kupferhydroxid löst sich in Salpetersäure ohne Stickoxide. Bei Sättigung färbt sich das Kupfernitrat von Blau zu grün bis schwarz.
Kupferhydroxid ist wasserunlöslich und das leicht lösliche Natriumsulfat kann man auswaschen.
Die Reaktion von HNO3 und Cu(OH)2 ergibt Kupfer(II)-nitrat ohne Stickoxidbildung.
Eigenschaften
Die Hydrate sind tiefblau, die wasserfreie Substanz ist blaugrün. Lösungen des Stoffes weisen mit zunehmender Konzentration eine Farbänderung von Blau nach Dunkelgrün auf. Die Kristalle zerfließen langsam an der Luft.[2]
Außer den genannten Hydraten kann Kupfer(II)-nitrat auch ein Nonahydrat ausbilden, das nur unter −20 °C beständig ist.[2]
Beim Erhitzen der Hydrate erfolgt keine Dehydratisierung, vielmehr entsteht ab ca. 80 °C basisches Kupfer(II)-nitrat, bei Temperaturen über 170 °C Kupfer(II)-oxid.
Der Stoff ist wassergefährdend (WGK 2).[1]
Verwendung
Kupfer(II)-nitrat wird verwendet als Weißblechtinte, zum Schwarzfärben von Kupfer und Brünieren von Eisen. Es wird weiterhin zur Herstellung von Kupferoxid, Korrosions- und Holzschutzmitteln, Flotations- und Bohrhilfsmitteln, in der Färberei und Farbstoffindustrie als Oxidationsmittel, sowie zur Nitrierung organischer Verbindungen verwendet.
Beim Auflösen von kupferhaltigen Silberlegierungen, z. B. Sterlingsilber in Salpetersäure ergeben sich Mischungen aus Kupfer- und Silbernitrat. Das Silbernitrat kann anschließend durch Zugabe von Chloridionen, beispielsweise in Kochsalz, als unlösliches Silberchlorid ausgefällt werden. Es bildet sich ein weißer Niederschlag und Natriumnitrat, das zusammen mit dem übrigen Kupfernitrat ausgewaschen werden kann.
AgNO3 + NaCl → AgCl↓ + NaNO3
Die andere Möglichkeit besteht in der Zugabe von metallischem Kupfer. In diesem Fall geht das Kupfer als tief blaues Kupfernitrat in Lösung, während metallisches Silber als ein grauer Niederschlag (Zementsilber) gefällt wird.
AgNO3 + Cu → CuNO3 + Ag↓
Das Zementsilber kann durch diesen Prozess einen Reinheitsgrad von ca. 98 bis 99 % erreichen, enthält aber noch eine kleine Menge Kupfer. Zementsilber kann elektrolytisch weiter zu einem Reinheitsgehalt von 999.9 raffiniert werden, dabei reichern sich weitere Edelmetalle wie Gold oder Metalle der Platingruppe in kleinen Mengen im Anodenschlamm an, während sich sehr reines Silber an der Kathode abscheidet und unedlere Metalle, vor allem noch Kupfer, im Elektrolyt gelöst bleiben. Kupfer im Elektrolyt und somit der Grad der Verunreinigung lässt sich leicht an der blauen Farbe erkennen, Silberionen sind farblos. Das beim Prozess anfallende Kupfernitrat kann ebenso elektrolytisch raffiniert werden, zur Erzeugung von Elektrolytkupfer von hoher Reinheit.
Einzelnachweise
Auf dieser Seite verwendete Medien
chemical structure of copper(II) nitrate
Copper(II) nitrate trihydrate
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances
Autor/Urheber: SebSchu95, Lizenz: CC0
Kupfer(II)-nitrat Kristalle Cu(NO3)2 • xH2O
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances









