Kragengeißeltierchen
| Kragengeißeltierchen | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Salpingoeca sp. | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Choanomonada | ||||||||||||
| Kent, 1880 | ||||||||||||
| ohne Rang | ||||||||||||
|
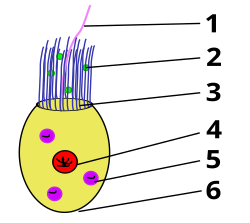
1 Geißel (Flagellum), 2 Nahrungsteilchen, 3 Mikrovilli, 4 Zellkern, 5 Nahrungsvakuole, 6 Basis
Kragengeißeltierchen (Choanomonada, auch Choanoflagellata) sind eine Gruppe einzelliger Lebewesen, die zu den Holozoa gerechnet werden. Durch ihre Ähnlichkeit mit den Kragengeißelzellen (Choanocyten) der Schwämme werden die Choanomonada als die nächsten einzelligen Verwandten der mehrzelligen Tiere angesehen.[1]
Merkmale
Kragengeißeltierchen sind mit Größen von in der Regel bis zu 10 µm vergleichsweise kleine Protisten. Kennzeichnend für sie ist vor allem ein „Kragen“ aus 30 bis 40 feinen, fadenförmigen Zellfortsätzen (Mikrovilli), der in dieser Form bei keiner anderen Protistengruppe existiert, und eine einzelne Geißel in dessen Zentrum, die über den Kragen hinausragt. Eine ehemals wohl vorhandene zweite Geißel ging im Lauf der Entwicklungsgeschichte verloren und lässt sich nur noch am erhalten gebliebenen Kinetosom nachweisen. Die Geißel dient festsitzenden Arten wie Codosiga botrytis dazu, eine Strömung zu erzeugen, um Nahrungspartikel den Kragen-Zellfortsätzen zuzuführen, frei schwimmenden Arten wie zum Beispiel Monosiga brevicollis außerdem auch zum Antrieb. Zwischen Kragen (in der englischsprachigen Fachliteratur collar) und Zellkern befindet sich ein Golgi-Apparat. Das Plasma enthält Mitochondrien. Das Zellende gegenüber der Geißel kann Filipodien tragen oder bei sessilen Arten einen Stiel ausbilden.
Die Gruppe der Acanthoecida bildet eine Lorica, eine korbähnliche Schutzhülle mit rippenartigen, silikathaltigen Verstärkungen.[1] Viele sessile Arten bilden Thecae aus, extrazelluläre, kelch- oder krugförmige, teils gestielte Zellhüllen.
Lebensweise
Kragengeißeltierchen kommen entweder als stationäre oder als frei schwebende Individuen bzw. Kolonien im Meer- wie im Süßwasser vor. Es gibt einzellige, frei schwimmende Arten wie Monosiga brevicollis, frei schwimmende Kolonien wie Salpingoeca rosetta und an Substrat fixierte Kolonien wie Codosiga botrytis. Sie schwimmen mit nach hinten gerichter Geißel (Schubgeißel).
Sie ernähren sich von organischen Partikeln, vor allem von im Wasser schwebenden Bakterien und von Viren,[2] die sie fangen, indem sie mit der Bewegung ihrer Geißel diese an ihren Kragen heranstrudeln. Das Wasser mit den Nahrungspartikeln wird von außen nach innen wie in einem Reusenapparat bewegt. Die Bakterien oder sonstigen Teilchen bleiben an der Außenseite der schleimüberzogenen Mikrovilli des Kragenapparates hängen und wandern mit dem Schleim zum Kragenansatz, wo sie in Nahrungsvakuolen transportiert und verdaut werden. Das elektronenmikroskopische Bild rechts unten zeigt einen Kragenflagellaten bei der Aufnahme von Nahrung.

Viele Arten lassen sich leicht kultivieren und haben eine Generationszeit von 6 bis 8 Stunden.[1] Die Vermehrung erfolgt sowohl asexuell als auch sexuell. Am häufigsten ist die asexuelle Vermehrung durch Längsteilung.[3] Bei der marinen Spezies Salpingoeca rosetta konnte nachgewiesen werden, dass durch bestimmte Bakterieninhaltsstoffe ein Schwärmen und eine anschließende sexuelle Vermehrung ausgelöst wird.[4]
Kragengeißeltierchen und Viren
„Choanovirus“ ist eine vorgeschlagene Gattung von Riesenviren aus dem Phylum Nucleocytoviricota (NCLDV), die Choanoflagellaten der Spezies Bicosta minor (Acanthoecidae) befällt.[5][6] Manche Kragengeißeltierchen ernähren sich jedoch unter anderem von Viren: Julia M. Brown et al. berichteten im September 2020 über den Fund von Virus-DNA in Choanoflagellaten und Picozoen (Picozoa). Bei der gefundenen viralen DNA handelte es sich überwiegend um die von Virophagen (Bakterienviren), also nicht um Viren dieser Einzeller (wie etwa „Choanovirus“) selbst. Da in den Einzellern aber keine Bakterien-DNA gefunden wurde, scheidet auch eine Aufnahme der Virus-DNA als Beifang zusammen mit etwaigen Bakterien aus. Die Autoren gehen daher davon aus, dass die Viren von den Choanoflagellaten als Nahrung aufgenommen wurden. Die Konsequenzen für die marine Ökologie und Fragen zum dadurch möglichen Gentransfer zwischen den Viren und den Einzellern müssen allerdings noch erforscht werden.[7]
Systematik
Äußere Systematik
Die Kragengeißeltierchen bilden zusammen mit den Vielzelligen Tieren (Metazoa) und einigen Einzellern das Taxon Holozoa:[8]
| Amorphea |
| ||||||||||||||||||||||||||||||
Innere Systematik
Die Kragengeißeltierchen stellen eine der Gruppen der sogenannten Holozoa dar. Sie wurden traditionell in drei weitere Gruppen unterteilt:[9]
- Monosigidae
- Salpingoecidae
- Acanthoecidae
Spätere Forschungsergebnisse führten jedoch durch die Zusammenfassung der Monosigidae und der Salpingoecidae zur Einteilung in nur noch zwei Gruppen:[10]
Ordnung Craspedida
15 Gattungen (ursprünglich)
- Astrosiga: Kent, 1880-1882[11]
- Aulomonas Lackey, 1942
- Barroeca Hake, Burkhardt, Richter & King, 2024 (neu)[12]
- Choanoeca Ellis, 1930
- Codonocladium Stein, 1878

- Codonosiga James-Clark, 1868
- Codosiga botrytis (Stielchen-Flagellat) kommt in stehenden Gewässern an Wasserpflanzen vor. Die Flagellaten sitzen einzeln oder in Gruppen an der Spitze eines Stiels, der 2-10 × so lang wie der Organismus ist. Die Zellgröße beträgt 8-30 µm. Die Organismen heften sich häufig an die Stiele von Glockentierchenen.[13]
- Desmarella Kent, 1880-1882
- Diploeca Ellis, 1930

- Monosiga Kent, 1880-1882
- Monosiga ovata (Eiförmiger Kragenflagellat) ist ein einzeln lebender, kugelig bis einförmiger Flagellat, der direkt oder mit kurzem Stiel auf einer Unterlage sitzt. Man findet ihn in stehenden Binnengewässern an Detritus, Wasserpflanzen und zum Teil auf Plankton aufsitzend. Die Größe beträgt 5-16 µm. Die Geißel ist etwa 20 µm lang.[13]
- Monosiga fusiformis (Spindelflagellat) lebt als Einzeller und sitzt mit zugespitztem Hinterende auf einer Unterlage fixiert. Es hat einen relativ großen Plasmakragen und zwei kontraktile Vakuolen. Es bevorzugt saubere stehende Süßgewässer und heftet sich oft an Plankton.[13]
- Pachysoeca Ellis, 1930
- Phalansterium Norris, in Parker, 1982.
- Phalansterium digitatum (Wasserfinger) ist eine Süßwasserart, die in kleinen stehenden Gewässern und zwischen nassen Moosen vorkommt. Die Organismen bestehen aus fingerförmlig verzweigten Gallertsäulen an deren Enden ein bis vier Flagellaten von 17 μm Größe sitzen. Die 35 μm langen Geißeln reichen weit über die Gallerte hinaus.
- Proterospongia Kent, 1880-1882
- Salpingoeca James-Clark, 1868
- Salpingoeca rosetta: Meeresbewohner
- Sphaeroeca Lauterborn, 1894
- Stelexomonas Lackey, 1942
- Stylochromonas Norris, in Parker, 1982
Ordnung Acanthoecida
Norris, 1965[11], 31 Gattungen
- Acanthocorbis Hara & Takahashi, 1984
- Acanthoeca Ellis, 1930
- Acanthoecopsis Leadbeater & Thomsen, 2000
- Amoenoscopa Hara & Takahashi, 1987
- Apheloecion Thomsen, 1983
- Bicosta Leadbeater, 1978
- Calliacantha Leadbeater, 1978
- Calotheca Thomsen & Moestrup, 1983
- Campyloacantha Hara & Takahashi, 1987
- Conion Thomsen, 1982
- Cosmoeca Thomsen, 1984
- Crinolina Thomsen, 1976
- Crucispina Espeland, 1986
- Diaphanoeca Ellis, 1930
- Diplotheca Valkanov, 1970
- Kakoeca Buck & Marchant, 1991
- Monocosta Thomsen, 1979
- Nannoeca Thomsen, 1988
- Parvicorbicula (Meunier, 1910) Deflandre, 1960
- Platypleura Thomsen, 1983
- Pleurasiga Schiller, 1925
- Polyfibula Manton, 1981
- Polyoeca Kent, 1880
- Saepicula Leadbeater, 1980
- Saroeca Thomsen, 1979
- Savillea (Ellis, 1930) Loeblich, 1967
- Spiraloecion Marchant & Perrin, 1986
- Sportelloeca Norris, in Parker, 1982
- Stephanacantha Thomsen, 1983
- Stephanoeca Ellis, 1930
- Syndetophyllum Thomsen & Moestrup, 1983
Evolution
Ein entscheidender Schritt der Evolution war der Übergang von Einzelzellen zu mehrzelligen Organismen, der sich mehrfach ereignet hat. Höhere Pflanzen, mehrzellige Algen, Pilze und tierische Metazoen haben diesen Schritt vollzogen. Der Übergang zur Mehrzelligkeit der Tiere war besonders markant, weil er den Beginn der sogenannten Kambrischen Explosion[14] markiert, die zur raschen Entstehung der meisten Tierstämme vor 530 Millionen Jahren führte. Durch den Vergleich von Proteinen, insbesondere Actin, α-Tubulin, und Elongationsfaktor-la, konnte festgestellt werden, dass sowohl Pilze als auch tierische Metazoen als gemeinsame Vorfahren einen Opisthokonten hatten.[15] Die Analyse von Mitochondrien-DNA zeigte, dass innerhalb der Opisthokonten die Kragengeißeltierchen den Metazoen am nächsten stehen und hier wiederum den Schwämmen.[16] Das legt auch die Morphologie nahe. Das Kragengeißelsystem der Kragengeißeltierchen ist mit hoher Wahrscheinlichkeit homolog zu dem der Choanozyten der Schwämme (Porifera); dies wird allerdings von einigen Forschern bestritten. Choanoflagellaten und aus Schwammorganismen isolierte Choanozyten sind morphologisch nicht zu unterscheiden. Schwämme und Kragengeißeltierchen bilden also gleichsam eine Brücke zwischen Ein- und Mehrzellern. Der Vergleich der Mitochondrien-DNA zeigt auch, dass Schwämme und Kragengeißeltierchen genetisch gut unterscheidbare Organismengruppen sind und nicht unterschiedliche Manifestationen der gleichen Gruppe. Auch frühere Theorien, die Mehrzelligkeit der Tiere sei mehrfach unabhängig voneinander entstanden, wurde widerlegt, weil keine andere Gruppe von Einzellern irgendeiner Gruppe von tierischen Metazoen näher steht als die Kragengeißeltierchen. Letztere sind also die Schwestergruppe der vielzelligen Tiere, d. h. unter den Einzellern ihre nächsten noch lebenden Verwandten.[16][17]
Nachweise
- Klaus Hausmann, Norbert Hülsmann, Renate Radek: Protistology, 3. Aufl., Schweizerbart, 2003, S. 81, ISBN 3-510-65208-8
- I. Ruiz-Trillo, A. J. Roger, G. Burger, M. W. Gray, B. F. Lang: A phylogenomic investigation into the origin of metazoa. In: Molecular biology and evolution. Band 25, Nummer 4, April 2008, S. 664–672, doi:10.1093/molbev/msn006, PMID 18184723.
- B. S. Leadbeater, Q. Yu, J. Kent, D. J. Stekel: Three-dimensional images of choanoflagellate loricae. In: Proceedings. Biological sciences / The Royal Society. Band 276, Nummer 1654, Januar 2009, S. 3–11, doi:10.1098/rspb.2008.0844, PMID 18755674, PMC 2581655 (freier Volltext) (Review).
Einzelnachweise
- ↑ a b c Tarja T Hoffmeyer, Pawel Burkhardt: Choanoflagellate models - Monosiga brevicollis and Salpingoeca rosetta. In: Current Opinion in Genetics & Development. Band 39, 2016, ISSN 1879-0380, S. 42–47, doi:10.1016/j.gde.2016.05.016, PMID 27318693.
- ↑ Brown JM, Labonté JM, Brown J, Record NR, Poulton NJ, Sieracki ME, Logares R und Stepanauskas R (2020) Single Cell Genomics Reveals Viruses Consumed by Marine Protists. In: Front. Microbiol. 11:524828. doi:10.3389/fmicb.2020.524828
- ↑ Serglei A Karpov, Barry S C Leadbeater: Cytoskeleton Structure and Composition in Choanoflagellates. In: The Journal of Eukaryotic Microbiology. Band 45, Nr. 3, 1998, ISSN 1066-5234, S. 361–367, doi:10.1111/j.1550-7408.1998.tb04550.x.
- ↑ Arielle Woznica, Joseph P. Gerdt, Ryan E. Hulett, Jon Clardy, Nicole King: Mating in the Closest Living Relatives of Animals Is Induced by a Bacterial Chondroitinase. In: Cell. Band 170, Nr. 6, 2017, S. 1175–1183.e11, doi:10.1016/j.cell.2017.08.005, PMID 28867285, PMC 5599222 (freier Volltext).
- ↑ Jan Osterkamp: Größtes Riesenvirus mit mysteriöser Zusatzausstattung, auf: Spektrum.de vom 23. September 2019
- ↑ David M. Needham, Susumu Yoshizawa, Toshiaki Hosaka, Camille Poirier, Chang Jae Choi, Elisabeth Hehenberger, Nicholas A. T. Irwin, Susanne Wilken, Cheuk-Man Yung, Charles Bachy, Rika Kurihara, Yu Nakajima, Keiichi Kojima, Tomomi Kimura-Someya, Guy Leonard, Rex R. Malmstrom, Daniel R. Mende, Daniel K. Olson, Yuki Sudo, Sebastian Sudek, Thomas A. Richards, Edward F. DeLong, Patrick J. Keeling, Alyson E. Santoro, Mikako Shirouzu, Wataru Iwasaki, Alexandra Z. Worden: A distinct lineage of giant viruses brings a rhodopsin photosystem to unicellular marine predators, in: PNAS, 23. September 2019, doi:10.1073/pnas.1907517116, inklusive Supplement 1 (xlsx)
- ↑ Julia M. Brown, Jessica M. Labonté, Joseph Brown, Nicholas R. Record, Nicole J. Poulton, Michael E. Sieracki, Ramiro Logares and Ramunas Stepanauskas: Single Cell Genomics Reveals Viruses Consumed by Marine Protists. Front. Microbiol. Band 11 Nr. 524828 vom 24. September 2020, doi: 10.3389/fmicb.2020.524828 (englisch). Dazu:
- Nadja Podbregar: Weltweit erste Virenfresser entdeckt, auf: scinexx.de vom 24. September 2020.
- Daniel Lingenhöhl: Viren als Nahrung, auf: spektrum.de vom 25. September 2020.
- Mike McRae: First Compelling Evidence of Organisms That Eat Viruses as a Food Source, auf: sciencealert vom 27. September 2020.
- ↑ B.F. Lang, C. O’Kelly, T. Nerad, M.W. Gray, G. Burger: The Closest Unicellular Relatives of Animals (= Current Biology. Band 12, Nr. 20). 2002, S. 1773–1778, doi:10.1016/S0960-9822(02)01187-9, PMID 12401173.
- ↑ Barry S.C. Leadbeater, Helge A. Thomsen: Order Choanoflagellida In: J. J. Lee, G. F. Leedale, P. C. Bradbury: An Illustrated Guide to the Protozoa. 2. Aufl., S. 14–38, Society of Protozoologists, Lawrence, Kansas, 2002.
- ↑ Adl, S. M., Simpson, A. G. B., Lane, C. E., Lukeš, J., Bass, D., Bowser, S. S., Brown, M. W., Burki, F., Dunthorn, M., Hampl, V., Heiss, A., Hoppenrath, M., Lara, E., le Gall, L., Lynn, D. H., McManus, H., Mitchell, E. A. D., Mozley-Stanridge, S. E., Parfrey, L. W., Pawlowski, J., Rueckert, S., Shadwick, L., Schoch, C. L., Smirnov, A. and Spiegel, F. W.: The Revised Classification of Eukaryotes. Journal of Eukaryotic Microbiology, 59: 429–514, 2012, doi:10.1111/j.1550-7408.2012.00644.x.
- ↑ a b John J Lee; Gordon F Leedale; Phyllis C Bradbury: An illustrated guide to the protozoa : organisms traditionally referred to as protozoa, or newly discovered groups. Lawrence, Kanada; USA : Society of Protozoologists, 2000.
- ↑ Kayley H. Hake, Patrick T. West, Kent McDonald, Davis Laundon, Josean Reyes-Rivera, Alain Garcia De Las Bayonas, Crystal Feng, Pawel Burkhardt, Daniel J. Richter, Jillian F. Banfield, Nicole King: A large colonial choanoflagellate from Mono Lake harbors live bacteria. Im: ASM Journals: mBio, Band 15, Nr. 9, 14. August 2024; doi:10.1128/mbio.01623-24, ResearchGate:383121087 (englisch).
- ↑ a b c Heinz Streble, Dieter Krauter: Das Leben im Wassertropfen. Kosmos, Stuttgart 1973, ISBN 3-440-04000-3.
- ↑ S Conway Morris.: The Cambrian ‘‘explosion’’ of metazoans and molecular biology: would Darwin be satisfied? In: International Journal of Developmental Biolology. Band 48, 2003, S. 505–515.
- ↑ S L Baldauf, J D Palmer: Animals and fungi are each other's closest relatives: congruent evidence from multiple proteins. In: Proceedings of the National Academy of Sciences of the United States of America. Band 90, Nr. 24, 15. Dezember 1993, ISSN 0027-8424, S. 11558–11562, doi:10.1073/pnas.90.24.11558, PMID 8265589, PMC 48023 (freier Volltext).
- ↑ a b Iñaki Ruiz-Trillo, Andrew J Roger, Gertraud Burger, Michael W Gray, B Franz Lang: A Phylogenomic Investigation into the Origin of Metazoa. In: Molecular Biology and Evolution. Band 25, Nr. 4, 2008, ISSN 1537-1719, S. 664–672, doi:10.1093/molbev/msn006.
- ↑ M Carr, B S C Leadbeater, R Hassan, M Nelson, S L Baldauf: Molecular phylogeny of choanoflagellates, the sister group to Metazoa. In: Proceedings of the National Academy of Sciences. Band 105, Nr. 43, 15. Oktober 2008, ISSN 0027-8424, S. 16641–16646, doi:10.1073/pnas.0801667105.
Weblinks
- Beitrag auf Tree of Life von Nicole King, Online
- Choanoflagellata Auf: Mikrobewiki, Kenyon College, Department of Biology.
- Ya Gao, Daisylyn Senna Tan, Mathias Girbig, Haoqing Hi, Xiaomin Zhou, Qianwen Xie, Shi Wing Yeung, Kin Shing Lee, Sik Yin Ho, Vlad Cojocaru, Jian Yan, Georg K. A. Hochberg, Alex de Mendoza, Ralf Jauch: The emergence of Sox and POU transcription factors predates the origins of animal stem cells. In: Nature Communications, Band 15, Nr. 9868, 14. November 2024; doi:10.1038/s41467-024-54152-x, hdl:1810/376326 (englisch). Dazu:
- Der Ursprung der Stammzellen: Proteine zur Regulation tierischer Stammzellen sind viel älter als das Tierreich selbst. Auf: Max-Planck-Gesellschaft (MPG) vom 15. November 2024.
- Michelle Starr: Genes Older Than Animal Life Itself Were Inserted Into Mice. Here's What Happened. Auf: sciencealert vom 3. Dezember 2024.
- Researchers Recreate Mouse from Choanoflagellate Gene that Predates Animals. Auf: sci.news vom 19. November 2024.
- Scientists Create “Extraordinary” Mouse Using Gene Older Than Animal Life Itself. Auf: SciTechDaily vom 19. November 2024.
Auf dieser Seite verwendete Medien
Autor/Urheber: Daniel Stoupin, Lizenz: CC BY-SA 3.0
Codosiga sp. isolated from Siberian soil
Codosiga sp cell at late stages of the life cycleAutor/Urheber: P. M. Sachertt Mendes F. M. Lansac-Tôha B. R. Meira F. R. Oliveira L. F. M. Velho F. A. Lansac-Tôha, Lizenz: CC BY-SA 4.0
Monosiga ovata Kent, 1880-1882. (A) Schematic drawing; (B) Photo, where the upper arrow indicates the ring surrounding the flagellum and the lower arrow indicates the termination of the flagellum. Scale of 5 µm.
Autor/Urheber: Sundance Raphael 22:35, 26 January 2007 (UTC), Lizenz: CC BY-SA 3.0
Kragengeißeltierchen Codonosiga
- Geißel (Flagellum)
- Nahrungsteilchen
- Plasmakragen
- Zellkern
- Nahrungsvakuole
- auf dem Untergrund festgewachsen
Autor/Urheber: Sergey Karpov, Lizenz: CC BY-SA 3.0
Monosiga ovata feeding (TEM)




