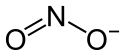
Kaliumnitrit
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Kaliumnitrit | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | KNO2 | |||||||||||||||
| Kurzbeschreibung | farblose bis gelbliche, leicht zerfließliche, hygroskopische, prismatische Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 85,10 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[3] | |||||||||||||||
| Dichte | 1,92 g·cm−3[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | Zersetzung[3] | |||||||||||||||
| Löslichkeit | sehr leicht in Wasser (2810 g·l−1 bei 20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Kaliumnitrit, KNO2 (nicht zu verwechseln mit Kaliumnitrat KNO3), ist das Kaliumsalz der Salpetrigen Säure HNO2.
Eigenschaften

Kaliumnitrit bildet farblose bis leicht gelbliche, stark hygroskopische Kristalle, die sich gut in Wasser unter Abkühlung lösen, die Lösung reagiert alkalisch. Die Kristalle zersetzen sich ab 410 °C zu Kaliumoxid, Stickstoffmonoxid und Stickstoffdioxid.[5]
Wenn die resultierenden Stickoxide nicht abgeführt werden können, reagieren sie mit unumgesetzten Kaliumnitrit zu Kaliumnitrat und Stickstoffmonoxid bzw. Stickstoff.[5]
Die Endprodukte der Zersetzung bei Temperaturbereich ab 410 °C sind Kaliumnitrat, Kaliumoxid und Stickstoff. Oberhalb von 600 °C zerfällt Kaliumnitrat in Kaliumnitrit und Sauerstoff, so dass die Endprodukte der Kaliumnitritzersetzung bei dieser Temperatur Kaliumoxid, Stickstoff und Sauerstoff sind.[5]
Sonst verhält es sich ähnlich wie Natriumnitrit, das heißt, es ist brandfördernd (vor allem bei höheren Temperaturen) und reagiert heftig mit Metallen wie Aluminium (vor allem in Pulverform!), trockenen Ammoniumverbindungen (wie beispielsweise Ammoniumsulfat), Cyaniden und vielen organischen Verbindungen. Es ist ein Reduktionsmittel und wird an der Luft langsam zu Kaliumnitrat KNO3 oxidiert.
Kaliumnitrit ist giftig; im Allgemeinen können Nitrite mit bestimmten Aminen bei geeigneten Bedingungen zu krebserregenden Nitrosaminen reagieren. Nitrit kann mit Eisen(II)-sulfat und konzentrierter Schwefelsäure durch Braunfärbung nachgewiesen werden.
Vorkommen und Herstellung
In der Natur kommen Nitrite als Zwischenstufen im Stickstoffkreislauf vor – sowohl bei der Nitrifikation (Stickstoffbindung) als auch bei der Denitrifikation (Stickstoff-Freisetzung). Technisch gewinnt man Kaliumnitrit durch Einwirkung von Stickoxiden auf Kaliumcarbonatlösung.[2][5]
Verwendung
Kaliumnitrit darf als Lebensmittelzusatzstoff der Nummer E 249 (Konservierungsmittel) unter bestimmten Auflagen im Nitritpökelsalz (Natriumchlorid mit Kaliumnitrit und Natriumnitrit) eingesetzt werden. Es verleiht dem Fleisch durch Bildung von Nitrosomyoglobin eine bleibende rote Farbe und beugt dem Befall durch Clostridium Botulinum vor. Die notwendige Zugabe pro Kilogramm Fleisch zum Zwecke der Konservierung beträgt ca. 100 mg/kg und für den gewünschten Effekt der Umrötung ca. 20 mg/kg.[6] Daher dürfen Fleisch- und Wursterzeugnisse ein Vielfaches des Trinkwassergrenzwertes von Nitrit enthalten.
Einzelnachweise
- ↑ Eintrag zu E 249: Potassium nitrite in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 23. August 2020.
- ↑ a b Eintrag zu Kaliumnitrit. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ a b c d e f g Eintrag zu Kaliumnitrit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Eintrag zu Potassium nitrite in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ a b c d W. Laue, M. Thiemann, E. Scheibler, K.W. Wiegand: Nitrates and Nitrites, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2012; doi:10.1002/14356007.a17_265.
- ↑ H. D. Belitz, W. Grosch, P. Schieberle: Lehrbuch der Lebensmittelchemie. 6. Auflage. Springer-Verlag, Berlin, Heidelberg 2008, ISBN 978-3-540-73201-3.
Auf dieser Seite verwendete Medien
Struktur des K+-Ions
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Global harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS): Piktogramm für giftige / toxische Chemikalien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for environmentally hazardous substances
Struktur des Nitrit-Ions