Kaliumnitrat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
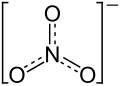 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Kaliumnitrat | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | KNO3 | ||||||||||||||||||
| Kurzbeschreibung | farbloser bis weißer Feststoff[3] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 101,11 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 2,11 g·cm−3 (20 °C)[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | gut in Wasser (316 g·l−1 bei 20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Kaliumnitrat (KNO3), auch als Bengalsalpeter, im allgemeinen Sprachgebrauch oft als Salpeter, im Speziellen als Kalisalpeter (früher auch „Salniter“: ‚gereinigter Salpeter‘[5]) bezeichnet, ist das Kaliumsalz der Salpetersäure.
Eigenschaften

Kaliumnitrat bildet farblose Kristalle, die sich in Wasser unter starker Abkühlung lösen. Es ist deshalb in warmem Wasser viel leichter löslich als in kaltem Wasser. In einem Liter Wasser von 0 °C können bis zu 130 g Kaliumnitrat gelöst werden, bei 100 °C sind es bis zu 2455 g Kaliumnitrat.
Kaliumnitrat zersetzt sich beim Erhitzen zu Kaliumnitrit und Sauerstoff:
Es ist bei erhöhten Temperaturen ein hervorragendes Oxidationsmittel. Verkohlte Rückstände in Glasgeräten lösen sich in geschmolzenem Kaliumnitrat rasch auf.
Kaliumnitrat ist deutlich weniger hygroskopisch als viele andere Nitrate, z. B. Natriumnitrat.
Gewinnung
Natürliche Vorkommen
Kaliumnitrat ist als natürliche Mineralbildung unter dem Namen Nitrokalit (lateinisch früher sal nitri: auch unreiner Salpeter) bekannt und kommt als Ausblühung auf Böden vor. Von wirtschaftlicher Bedeutung waren die Vorkommen in China und Südostasien, wo in der ersten Hälfte des 19. Jahrhunderts durch Auslaugen solcher Böden mehr als 10.000 t Salpeter jährlich gewonnen wurden.
Bakterielle Nitrifikation stickstoffreicher organischer Abfälle
Von Ende des 14. bis in das 19. Jahrhundert wurde in Europa mithilfe von Bakterien und Luftsauerstoff Salpeter erzeugt, um vom Import dieses für Kriegszwecke unentbehrlichen Rohstoffes unabhängig zu sein (siehe „Geschichte“). Man vermengt stickstoffreiche organische Abfälle (Dung und Harn) mit Kalk und Holzasche (Pottasche) und lässt diese in lockeren, luftdurchlässigen Erdhaufen verwesen. Dabei werden die Stickstoffverbindungen durch Bakterien zu Nitraten umgesetzt. Nach zwei Jahren wird die Masse mit Wasser ausgelaugt. Der Rohlauge (insbesondere bestehend aus Natronsalpeter bzw. Natriumnitrat)[6] wird Pottasche (Kaliumcarbonat) zugesetzt und dadurch Calcium- und Magnesiumnitrat zu Kaliumnitrat und schwerlöslichem Erdalkalicarbonat umgesetzt. Durch Eindampfen der filtrierten Lauge gewinnt man den Kalisalpeter, der durch Umkristallisation gereinigt wird.
Konversionssalpeter
Von Mitte des 19. Jahrhunderts bis etwa 1920 war die Konversion von Chilesalpeter mit Kaliumchlorid aus dem deutschen Kalibergbau das wichtigste Verfahren zur Herstellung von Kaliumnitrat:
Dabei wird die geringe Zunahme der Löslichkeit von Natriumchlorid mit der Temperatur ausgenutzt: Die Mutterlauge der KNO3-Kristallisation im vorausgegangenen Zyklus wird erwärmt und mit reinem Natriumnitrat und Kaliumchlorid (in stöchiometrischen Mengen) versetzt. Das Gemisch wird unter Zusatz von etwas Soda bei 100 °C eingeengt, wobei Natriumchlorid und Verunreinigungen (Erdalkalicarbonate) ausfallen und abfiltriert werden. Das Filtrat wird mit dem Kondensat der Eindampfung wieder verdünnt, um beim Abkühlen ein Ausfällen von Natriumsalzen zu vermeiden, klarfiltriert, dann auf 5 °C zur Kristallisation des Kaliumnitrats abgekühlt und zentrifugiert. Das abgeschiedene Kaliumnitrat wird für technische Zwecke umkristallisiert.
Synthetisch aus Salpetersäure
Heute wird Kaliumnitrat synthetisch aus Salpetersäure hergestellt (siehe Darstellung).
Darstellung
Es gibt viele – theoretische und praktikable – Möglichkeiten Kaliumnitrat darzustellen:
- fast alle durch Salzbildungsreaktionen:
Das gebildete Ammoniumcarbonat zerfällt ab etwa 60 °C zu Ammoniak, Kohlenstoffdioxid und Wasser.[7]
Verwendung
- Kaliumnitrat wird zur Haltbarmachung von Lebensmitteln verwendet (Pökelsalz E 252).
- Es ist der Hauptbestandteil von Schwarzpulver.
- Ein Gemisch aus 24 % Bor + 71 % KNO3 + 5 % Binder dient als zuverlässige Anzündmischung, die auch bei sehr tiefen Temperaturen (−196 °C) brennt.
- Eine Mischung aus 60 % NaNO3 + 40 % KNO3 schmilzt bei 222 °C und wird als Wärmeträgermedium in solarthermischen Kraftwerken eingesetzt. Diese Salzschmelze ist chemisch stabil bis 590 °C, hat eine hohe spezifische Wärmekapazität von 1,55 kJ/(kg·K), eine Dichte von 1,79 g/cm3 und ist dünnflüssig wie Wasser (Viskosität: 2,1 mPa·s). Sie benetzt Metallflächen sehr leicht, was bei ungeeigneter Konstruktion und Materialauswahl zu Dichtungsproblemen führen kann. Rostfreier Stahl ist weitgehend beständig gegen Salpeterschmelzen (Abtragungsrate: 6–15 µm/Jahr bei 570 °C). Der Wärmeübergangskoeffizient am turbulent durchströmten Rohr beträgt etwa 6000 W/K·m2. Die Salpeterschmelze eignet sich aufgrund ihrer hohen Wärmekapazität (2,8 MJ/(K·m3)) zudem als Wärmespeichermedium. Durch Zusatz von Natriumnitrit kann die Schmelztemperatur weiter erniedrigt werden. Ein als HiTec bezeichnetes Salzgemisch aus 53 % KNO3 + 40 % NaNO2 + 7 % NaNO3 schmilzt bereits bei 140 °C und hat besonders günstige Eigenschaften als Wärmeträgermedium, wenn die Giftigkeit von Natriumnitrit ohne Belang ist.
- Salpeterbäder werden zur Wärmebehandlung von Aluminiumknetlegierungen mit Magnesiumgehalten bis 10 % verwendet. Die höchstzulässige Temperatur der Salzschmelze ist vom Magnesiumgehalt abhängig; sie sinkt von 550 °C bei 0,5 % Mg auf 380 °C bei 10 % Mg.
- in Dünger
- in Zahnpasta für schmerzempfindliche Zähne[8]
- Qualitativer Nachweis von Mangan und Chrom in der Soda-Salpeter-Schmelze.
Geschichte
Bereits im 11. Jahrhundert wird Salpeter im Buch des Marcus Graecus, das auch erstmals die Schwarzpulvermischung erwähnt, als neuer Stoff genannt, der von Erde und Steinen abgekratzt wird. Das vom Ende des 13. Jahrhunderts stammende Buch über den berittenen Kampf und den Einsatz von Kriegsmaschinen von Hasan al-Rammah (Al-Furusiyya wa al-Manasib al-Harbiyya) enthält bereits mehrere Vorschriften zur Reinigung des Salpeters mit Holzasche sowie zur Anfertigung von Brandsätzen und Treibstoff für Raketen.
Salpeter wurde anfangs aus Indien importiert; Venedig zog aus dem Zwischenhandel hohe Gewinne. Mit steigender Nachfrage und aus Gründen der Unabhängigkeit förderten vom Ende des 14. Jahrhunderts an die Regierungen die eigene Gewinnung von Salpeter und sicherten sich durch ein „Salpeterregal“ alle Rechte der Herstellung, des Importes und der Verwendung mittels drakonischer Gesetze. Durch die schnelle Sauerstoffabgabe war der Salpeter die Grundlage für die plötzliche Verbrennung von Schwefel und Holzkohle im Schießpulver und daher als chronisch knappe Substanz der strategische Rohstoff über sechs Jahrhunderte.
In Thüringen gab es im 16. Jahrhundert neun Salpetersiedereien. Die Moldauufer bei Prag waren mit „Sanitärbänken“ bedeckt, die Stadt Halle erteilte eine Konzession zur Salpetergewinnung an den Müllhalden. Die steigende Nachfrage nach Salpeter wurde teilweise durch weitere Importe, vor allem aus Indien, und durch eigene Anlagen gedeckt.
Ab dem Ende des 14. Jahrhunderts fand ein systematischer Anbau von Salpetergärten statt. Tierische Abfälle (Dung, Kot, Urin und Blut) wurden mit kalkhaltigen Erden, Erde von Fried- bzw. Schlachthöfen oder aus Mooren und mit Kalk, Schutt sowie Asche in Gruben gefüllt oder zu Haufen geschichtet und ab und zu mit Jauche oder Urin begossen. Durch die Zersetzung bildete sich nach ein bis zwei Jahren so viel Salpeter, dass er aus der Erde ausgewaschen werden konnte. Die Ausbeute betrug etwa 6:1, aus 6 kg Salpetererde gewann man 1 kg Salpeter.
Salpetersieder als besonderer und sehr unbeliebter Berufsstand durften Grundstücke jederzeit betreten und dort nach Salpeter suchen. Das traf sogar für Kirchen im 17. und 18. Jahrhundert zu, wobei nur die Zeiten der Gottesdienste ausgenommen waren. In Schweden mussten die Bauern ihre Abgaben sogar teilweise in Salpeter entrichten.
1879 bis 1884 führte Chile den Salpeterkrieg gegen seine Nachbarländer Peru und Bolivien, um in den alleinigen Besitz der großen Wüstenlagerstätten von Natronsalpeter (Chilesalpeter; „Caliche“) zu gelangen, der mit Kalisalzen sofort zum Kalisalpeter umgesetzt werden konnte. Dieses Verfahren der Konversion wurde ab 1916 vom Haber-Bosch-Verfahren, der Erzeugung von Ammoniak aus Luft und Wasser mit nachfolgender Umsetzung zur Salpetersäure, abgelöst.
Literatur
- R. H. Perry: Chemical Engineers´ Handbook. 4th ed., McGraw-Hill Book Company, New York, 1963, pp. 9–77
- G. H. Janz et al.: Physical Properties Data Compilations Relevant to Energy Storage II. Molten Salts, NSRDS, April, 1979
- Seel, Wolfgang: Preußisch-deutsche Pulvergeschichte. Deutsches Waffen-Journal 19 (1983) Nr. 3, S. 294–301, Nr. 4, S. 462–465, Nr. 5, S. 588–592, Nr. 7, S. 862–867, Nr. 8, S. 1020–1023, Nr. 9, S. 1144–1146, 44 Abb.
- Seel, Wolfgang: Altpreußische Salpeterwirtschaft. Waffen- und Kostümkunde B. 25 (1983) H. 1, S. 31–41, 4 Abb.
- J. Gartz: Kulturgeschichte der Explosivstoffe. E. S. Mittler & Sohn, Hamburg, 2006
- M. Baetz: Schwarzpulver für Survival Band 1 Improvisation von Schwarzpulver und ähnlichen Mischungen, S. 70, 2005, Fuldaer Verlagsanstalt
Einzelnachweise
- ↑ Eintrag zu E 252: Potassium nitrate in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- ↑ Eintrag zu POTASSIUM NITRATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 25. Februar 2020.
- ↑ a b c d e f g Eintrag zu Kaliumnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ Eintrag zu Kaliumnitrat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- ↑ Wilhelm Hassenstein: Das Feuerwerksbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck unter dem Titel Büchsenmeysterei mit Übertragung ins Hochdeutsche und Erläuterungen, München 1941, S. 40, 53, 59, 67, 106 und 114.
- ↑ Irene Strube, Rüdiger Stolz, Horst Remane: Geschichte der Chemie: Ein Überblick von den Anfängen bis zur Gegenwart. Berlin 1986, S. 46.
- ↑ M. Baetz: Schwarzpulver für Survival Band 1 Improvisation von Schwarzpulver und ähnlichen Mischungen, S. 70, 2005, Fuldaer Verlagsanstalt.
- ↑ Potassium nitrate. Drugs.com, abgerufen am 15. November 2015 (englisch).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for oxidizing substances
Struktur des K+-Ions
Nitrat-Anion
Nadelförmiges, grobkristallines Kaliumnitrat




