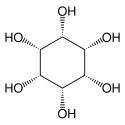
Inosit
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Strukturformel von myo-Inosit | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Inosit | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H12O6 | ||||||||||||||||||
| Kurzbeschreibung | weißer, kristalliner, geruchloser Feststoff[1] mit süßlichem Geschmack | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 180,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | 1,75 g·cm−3 [1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | 143 g·l−1 (19 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Inosit (der Inosit; auch, vor allem englisch: Inositol; veraltet: „Muskelzucker“) ist der Trivialname für Cyclohexanhexol, einen sechswertigen cyclischen Alkohol.
Obwohl Inosit den Trivialnamen „Muskelzucker“ trägt, handelt es sich dabei nicht um ein Kohlenhydrat, da es keine Carbonylgruppe besitzt und daher kein cyclisches Halbacetal bilden kann. Er erfüllt lediglich das ursprüngliche Kriterium eines Kohlen-Hydrats (hydratisierter Kohlenstoff), nämlich dass dessen Summenformel Cn(H2O)n ist bzw. dass Inosit ein Isomer (dieselbe Summenformel) zu Glucose und Fructose ist.
Die eigentlich aus dem angloamerikanischen Sprachraum stammende Variante Inositol hat sich in den Naturwissenschaften eingebürgert, vor allem in zusammengesetzten Begriffen ist sie die weitaus gebräuchlichere Variante.
Früher wurde myo-Inosit den B-Vitaminen zugerechnet und teils (wie auch Adenosinmonophosphat) als „Vitamin B8“ bezeichnet.
Isomerie
Abhängig von der Stellung der Hydroxygruppen sind neun Stereoisomere möglich, davon ein Enantiomerenpaar (chiro-Inosit). Bei der in der Natur häufigsten Form stehen die Hydroxygruppen an den Kohlenstoffatomen 1, 2, 3 und 5 auf derselben Seite des Rings und die Hydroxygruppen an C4 und C6 auf der gegenüberliegenden Seite. Diese Form trägt den systematischen Namen Cyclohexan-cis-1,2,3,5-trans-4,6-hexol, den Trivialnamen myo-Inosit und kommt in vielen tierischen und pflanzlichen Geweben vor.
Die Trivialnamen der anderen seltenen Isomere sind: scyllo-, D-chiro-, L-chiro-, muco-, neo-, allo-, epi- und cis-Inosit.
Alle Isomere haben einen süßlichen Geschmack.
Vorkommen und Bedeutung
Im Körper tritt Inosit zumeist mit Phosphaten verestert auf. Er wurde früher den B-Vitaminen zugeordnet. Aufgrund der Tatsache, dass der menschliche Körper Inosit aus Glucose selbst aufbauen kann, gilt diese Einordnung allerdings mittlerweile als veraltet. Jede der beiden menschlichen Nieren produziert beispielsweise ca. 2 g Inosit pro Tag, in Summe also 4 g/d. Dies ist ein Vielfaches der Menge, die täglich mit der Nahrung aufgenommen wird (225 bis 1800 mg/d, durchschnittlich 900 mg/d bei einer Standard-Diät von 2500 kcal/d). Andere Körperzellen können ebenfalls Inosit bilden und tragen geringfügig zur Versorgung bei. Die höchsten Inosit-Konzentrationen werden im Gehirn gemessen, wo er als sekundärer Botenstoff und Teil von Neurotransmittern fungiert.[12] Bei Mikroorganismen wirkt Inosit als Wachstumsfaktor und wird dort als Bios I bezeichnet. In nahezu allen höheren Pflanzen tritt er als Komponente von Sphingolipiden auf. In Pilzen, Bakterien und manchen höheren Pflanzen kommt der Alkohol vorwiegend als Phytinsäure (Inositolhexaphosphorsäure) zur Phosphatspeicherung vor.[13]
Sekundärer Botenstoff
Das 1D-myo-Inositol-1,4,5-trisphosphat (vereinfacht Inositoltrisphosphat, IP3) und andere Phosphoinositole spielen als sekundärer Botenstoff bei der Signalübertragung in Zellen eine wichtige Rolle. Es wird dabei durch Phospholipase-vermittelte hydrolytische Spaltung des Phospholipids Phosphatidylinositol-4,5-bisphosphat (PIP2) – in ein 1,2-Diacylglycerin (DAG) und eben IP3 – freigesetzt. IP3 ist in der Lage, den Zellstoffwechsel zu beeinflussen, so bewirkt es beispielsweise den Anstieg der Ca2+-Konzentration innerhalb der Zelle.
Siehe auch:
- Signalwege des Insulins
- Inositol-1,4,5-triphosphat (IP3) als sekundärer Botenstoff
- Funktion der Phospholipase C, Signaltransduktion bei der Proteinkinase C
- Endoplasmatisches Retikulum als Calcium-Speicher
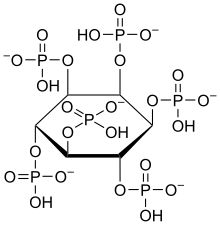
Gewinnung
myo-Inosit wird durch Hydrolyse von Phytinsäure gewonnen, die wiederum aus Maisquellwasser isolierbar ist:
Verwendung
Inosit ist im Handel als Nahrungsergänzungsmittel für Menschen oder Pferde erhältlich. Aufgrund seiner optischen Ähnlichkeit, der leichten Verfügbarkeit und des geringen Preises wird Inositpulver oft zum Strecken von Kokain oder Methamphetamin verwendet.[14] Es findet sich auch in verschiedenen Energydrinks.
Inosit wird in der Behandlung des Polyzystischen Ovar-Syndroms (PCOS)[15] eingesetzt. Studien zufolge kann Inosit bei PCOS und bei Prädiabetes und Übergewicht dazu beitragen, die Insulinresistenz und Hyperinsulinismus zu verringern.[15][16]
Historisches
Der deutsche Chemiker Johann Joseph von Scherer, ein Schüler Justus Liebigs und späterer Professor in Würzburg, isolierte Inosit aus Muskelgewebe und schlug in seiner Veröffentlichung 1850 „nach seinem ersten Fundorte“ den Namen „Inosit“ vor[17], nach dem griechischen „is“, Genitiv „inos“, für Sehne, Muskel.[18]
Nachweis
Der Nachweis von Inosit kann durch Oxidation mit Salpetersäure erfolgen, wobei Rhodizonsäure C6H2O6 entsteht, die ein charakteristisches rotes Bariumsalz bildet. Diese 1852 von Johann Josef von Scherer publizierte Reaktion[19], bei der das Molekülgerüst, der Kohlenstoffsechsring, erhalten bleibt, wird nach ihrem Entdecker auch Scherer-Reaktion genannt.[20]
Einzelnachweise
- ↑ a b c d e f Datenblatt Inosit bei Alfa Aesar, abgerufen am 17. Februar 2013 (Seite nicht mehr abrufbar).
- ↑ Datenblatt myo-Inosit bei Merck, abgerufen am 11. Januar 2017.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu myo-Inositol: CAS-Nr.: 87-89-8, EG-Nr.: 201-781-2, ECHA-InfoCard: 100.001.620, ChemSpider: 10239179, DrugBank: DBDB13178, Wikidata: Q3331426.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu scyllo-Inositol: CAS-Nr.: 488-59-5, EG-Nr.: 610-437-4, ECHA-InfoCard: 100.113.358, ChemSpider: 10254646, DrugBank: DBDB03106, Wikidata: Q3023527.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu muco-Inositol: CAS-Nr.: 488-55-1, EG-Nr.: 207-681-5, ECHA-InfoCard: 100.006.983, ChemSpider: 16736990, Wikidata: Q743661.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu D-chiro-Inositol: CAS-Nr.: 643-12-9, EG-Nr.: 211-394-0, ECHA-InfoCard: 100.010.359, ChemSpider: 10254647, Wikidata: Q3011024.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu L-chiro-Inositol: CAS-Nr.: 551-72-4, EG-Nr.: 209-000-7, ECHA-InfoCard: 100.008.183, ChemSpider: 10199754, DrugBank: DBDB15350, Wikidata: Q3205874.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu neo-Inositol: CAS-Nr.: 488-54-0, ChemSpider: 10199749, Wikidata: Q3347078.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu allo-Inositol: CAS-Nr.: 643-10-7, EG-Nr.: 211-393-5, ECHA-InfoCard: 100.010.358, PubChem: 135058350, ChemSpider: 16736991, Wikidata: Q2838375.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu epi-Inositol: CAS-Nr.: 488-58-4, EG-Nr.: 207-682-0, ECHA-InfoCard: 100.006.984, ChemSpider: 10254648, Wikidata: Q3589114.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu cis-Inositol: CAS-Nr.: 576-63-6, ChemSpider: 16736992, Wikidata: Q2974313.
- ↑ Marine L. Croze, Christophe O. Soulage: Potential role and therapeutic interests of myo-inositol in metabolic diseases. In: Biochimie. Band 95, Nr. 10, Oktober 2013, S. 1811–1827, doi:10.1016/j.biochi.2013.05.011, PMID 23764390.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Inositole im Lexikon der Chemie, abgerufen am 4. Juni 2008.
- ↑ National Drug Intelligence Center: South Carolina Drug Threat Assessment: Methamphetamine, Dezember 2001
- ↑ a b V. Unfer, J. E. Nestler, Z. A. Kamenov, N. Prapas, F. Facchinett: Effects of Inositol(s) in Women with PCOS: A Systematic Review of Randomized Controlled Trials. In: International Journal of Endocrinology. Band 2016, 2016, S. 1849162, doi:10.1155/2016/1849162, PMID 27843451, PMC 5097808 (freier Volltext).
- ↑ C. Bañuls, S. Rovira-Llopis, S. López-Doménech, S. Veses, V. M. Víctor, M. Rocha, A. Hernández-Mijares: Effect of consumption of a carob pod inositol-enriched beverage on insulin sensitivity and inflammation in middle-aged prediabetic subjects. In: Food & Function. Band 7, Nr. 10, Oktober 2016, S. 4379–4387, doi:10.1039/c6fo01021k, PMID 27713964.
- ↑ Johann Josef von Scherer: Ueber eine neue, aus dem Muskelfleische gewonnene Zuckerart. In: Friedrich Wöhler, Justus Liebig (Hrsg.): Annalen der Chemie und Pharmacie. Band 73, Nr. 3. Christian Friedrich Winter, Heidelberg 1850, S. 322–328, doi:10.1002/jlac.18500730303 (hathitrust.org).
- ↑ A.K.M. Shamsuddin, Guang-Yu Yang: Inositol & its Phosphates : basic science to practical applications. Bentham Science Publishers, Sharjah 2015, ISBN 978-1-68108-008-6 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Johann Josef von Scherer: Ueber den Inosit. In: Friedrich Wöhler, Justus Liebig, Hermann Kopp (Hrsg.): Annalen der Chemie und Pharmacie. Band 81, Nr. 3. Christian Friedrich Winter, Heidelberg 1852, S. 375–375, doi:10.1002/jlac.18520810313 (archive.org).
- ↑ S. J. Angyal: Inositols. Chemistry, Physiology, Pathology, Methods. In: W. H. Sebrell Jr., Robert S. Harris (Hrsg.): The Vitamins. second edition Auflage. Band III. Academic Press, Elsevier, New York und London 1971, ISBN 978-0-12-633763-1, S. 340–415, doi:10.1016/b978-0-12-633763-1.50010-5 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Struktur von myo-Inositol
Allo-inositol
Autor/Urheber: Hbf878, Lizenz: CC0
Chemcial structure of phytate, also known as inositol hexakisphosphate (IP6).
Protonation
Autor/Urheber: Created by Kupirijo, cropped by CMBJ, Lizenz: CC BY 3.0
Chemical structure of L-chiro-inositol
Autor/Urheber: Hbf878, Lizenz: CC0
D-chiro-inositol (cropped from Chiro-inositol.svg).

![myo-[3]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/0b/Myo-inositol.svg/150px-Myo-inositol.svg.png)
![scyllo-[4]](http://upload.wikimedia.org/wikipedia/commons/thumb/5/50/Scyllo-inositol.svg/150px-Scyllo-inositol.svg.png)
![muco-[5]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b5/Muco-inositol.svg/150px-Muco-inositol.svg.png)
![D-(+)-chiro-[6]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/D-chiro-inositol.svg/150px-D-chiro-inositol.svg.png)
![L-(−)-chiro-[7]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b6/L-chiro-inositol.svg/150px-L-chiro-inositol.svg.png)
![neo-[8]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e0/Neo-inositol.svg/150px-Neo-inositol.svg.png)
![allo-[9]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/74/Allo-inositol.svg/150px-Allo-inositol.svg.png)
![epi-[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e7/Epi-inositol.svg/150px-Epi-inositol.svg.png)
![cis-[11]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/73/Cis-inositol.svg/150px-Cis-inositol.svg.png)