Halogenaromaten
Halogenaromaten (auch Halogenarene oder Arylhalogenide) leiten sich von der Gruppe der Aromaten oder Arene ab, bei denen ein oder mehrere Wasserstoffatome durch Elemente der 7. Hauptgruppe (Halogene) – Fluor, Chlor, Brom und Iod – des Periodensystems ersetzt wurden. Verbindungen des radioaktiven Elements Astat sind aufgrund der kurzen Halbwertszeit des Astats kaum erforscht.
Aromatische Halogenverbindungen sind mitunter hochgiftig und werden oder wurden als Insektizide oder Fungizide eingesetzt. Viele davon sind mittlerweile verboten.
Ausgewählte Beispiele
- Chlorbenzol, ein wichtiges Lösungsmittel für Öle, Fette, Harze usw.,
- 2-Chlorphenol, ein Desinfektionsmittel,
- CS-Gas, ein Tränengas,
- DDT, ein in den meisten westlichen Industrieländern seit den 1970er-Jahren verbotenes Insektizid,
- Decabromdiphenylether und Tetrabrombisphenol A sind Flammschutzmittel,
- Eosin, ein roter Farbstoff, der aus Steinkohleteer gewonnen wird,
- Merbromin (INN) ein dem Eosin ähnlicher Farbstoff, der vor 2003 in Deutschland als Antiseptikum (Handelsname Mercuchrom) vertrieben wurde.
Stammverbindungen
| Strukturformel |  |  |  |  |
| Name | Fluorbenzol | Chlorbenzol | Brombenzol | Iodbenzol |
| Schmelzpunkt | −42 °C[1] | −45 °C[2] | −31 °C[3] | −29 °C[4] |
| Siedepunkt | 85 °C[1] | 132 °C[2] | 156 °C[3] | 188 °C[4] |
| Kalottenmodell |  |  |  |  |
Die einfachsten Verbindungen sind die mit einem Halogenatom substituierten Benzole; sie bilden daher die Stammverbindungen der Halogenaromaten.
Darstellung
Chlor- und Brombenzol können durch Halogenierung mittels Chlor bzw. Brom in Gegenwart einer Lewis-Säure dargestellt werden.
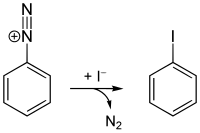
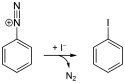
Ausgehend von Anilin können alle vier halogenierten Benzole mittels Diazotierung dargestellt werden. Chlor-, Brom- und Iodbenzol sind über die Sandmeyer-Reaktion zugänglich, für Fluorbenzol findet die Schiemann-Reaktion Anwendung.
- Ph–NN+[BF4]− Ph–F + N2 + BF3
Eigenschaften
Physikalische Eigenschaften
Die Monohalogenbenzole sind farblose Flüssigkeiten. Mit zunehmender molarer Masse steigen die Siedepunkte an. Bei den Schmelzpunkten sind diese Unterschiede nicht so stark ausgeprägt. Vom Fluor- (−42 °C) zum Chlorbenzol (−45 °C) ist sogar ein Fallen des Wertes festzustellen, während er dann zu Brom (−31 °C) und Iod (−29 °C) hin moderat steigt.
Chemische Eigenschaften
Eine charakteristische Reaktion der Halogenaromaten ist die Nukleophile aromatische Substitution. Diese Reaktion läuft meist nach dem Additions-Eliminierungs-Mechanismus ab. Halogenaromaten unterliegen eher selten nukleophilen Substitutionen, außer in hochenergetischen industriellen Prozessen.
Halogenaromaten reagieren mit Magnesiummetall zu Grignard-Verbindungen, die als "Ar−"-Reagenzien anzusehen sind.
Halogenaromaten mit zwei Halogensubstituenten
Substituiert man Benzol mit zwei Halogenen, so ergeben sich insgesamt zehn Kombinationen. Innerhalb jeder Kombination gibt es ortho-, meta- und para-Isomere.
| Fluorbenzol (–F) | Chlorbenzol (–Cl) | Brombenzol (–Br) | Iodbenzol (–I) | |
| Fluorbenzol (–F) | Difluorbenzole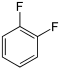  | Fluorchlorbenzole | Fluorbrombenzole | Fluoriodbenzole |
| Chlorbenzol (–Cl) | Dichlorbenzole 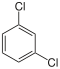 | Chlorbrombenzole | Chloriodbenzole | |
| Brombenzol (–Br) | Dibrombenzole 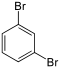 | Bromiodbenzole | ||
| Iodbenzol (–I) | Diiodbenzole 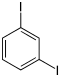 |
Halogenaromaten mit anderen funktionellen Gruppen
Auch von bekannten aromatischen Stammverbindungen, wie Phenol, Anilin, Anisol, Toluol, Nitrobenzol, Benzylalkohol, Benzaldehyd, Benzoesäure usw. gibt es halogensubstituierte Derivate. Der Name der Stammverbindung ändert sich dabei nicht. Der Halogensubstituent wird als Silbe (Präfix) darvorgesetzt. Innerhalb jeder Gruppe gibt es ortho-, meta- und para-Isomere.
Der −I-Effekt des Halogensubstituenten führt bei den Halogenphenolen und Halogenbenzoesäuren zu einer höheren Acidität im Vergleich zu Phenol bzw. Benzoesäure. Die pKs-Werte sind daher entsprechend niedriger (Phenol: 9,99[5] / Halogenphenole: 9,06[6] – Benzoesäure: 4,20[5] / Halogenbenzoesäuren: 3,58[6]).
| –F | –Cl | –Br | –I | |
| Phenol (–OH) | Fluorphenole | Chlorphenole | Bromphenole | Iodphenole |
| Anilin (–NH2) | Fluoraniline | Chloraniline | Bromaniline | Iodaniline |
| Anisol (–OCH3) | Fluoranisole | Chloranisole | Bromanisole | Iodanisole |
| Toluol (–CH3) | Fluortoluole | Chlortoluole | Bromtoluole | Iodtoluole |
| Nitrobenzol (–NO2) | Fluornitrobenzole | Chlornitrobenzole | Bromnitrobenzole | Iodnitrobenzole |
| Benzylalkohol (–CH2OH) | Fluorbenzylalkohole | Chlorbenzylalkohole | Brombenzylalkohole | Iodbenzylalkohole |
| Benzaldehyd (–CHO) | Fluorbenzaldehyde | Chlorbenzaldehyde | Brombenzaldehyde | Iodbenzaldehyde |
| Benzoesäure (–COOH) | Fluorbenzoesäuren | Chlorbenzoesäuren | Brombenzoesäuren | Iodbenzoesäuren |
Halogenierte Heteroaromaten
Zur Gruppe der Halogenaromaten zählen auch die halogenierten Heteroaromaten, z. B. 2-Chlorpyridin, 2,6-Dibrompyridin, 2,4,6-Trichlortriazin, 2,4,6-Trifluortriazin oder das Insektizid Chlorpyrifos.
Einzelnachweise
- ↑ a b Eintrag zu Fluorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu Chlorbenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Eintrag zu Brombenzol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 26. Dezember 2019. (JavaScript erforderlich)
- ↑ a b Datenblatt Iodbenzol bei Sigma-Aldrich, abgerufen am 26. Dezember 2019 (PDF).
- ↑ a b CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- ↑ a b Die angegebenen Werte sind Durchschnittswerte sämtlicher pKs-Werte der fraglichen Derivate und dienen hier lediglich zur Veranschaulichung.
Literatur
- K. Peter C. Vollhardt, Neil E. Schore: Organische Chemie, 4. Auflage, Wiley-VCH, Weinheim 2005, ISBN 978-3-527-31380-8, S. 823–824, 1170.
- Allinger, Cava, de Jongh, Johnson, Lebel, Stevens: Organische Chemie, 1. Auflage, Walter de Gruyter, Berlin 1980, ISBN 3-11-004594-X, S. 19, 548–556, 602–669.
- Morrison / Boyd: Lehrbuch der Organischen Chemie, 3. Auflage, Verlag Chemie, Weinheim 1986, ISBN 3-527-26067-6, S. 700–702, 1113.
- Streitwieser / Heathcock: Organische Chemie, 1. Auflage, Verlag Chemie, Weinheim 1980, ISBN 3-527-25810-8, S. 692–695, 1053–1064.
- Beyer / Walter: Lehrbuch der Organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2, S. 445–453.
Auf dieser Seite verwendete Medien
1,2-Diiodbenzol; o-Diiodbenzol
m-Dibrombenzol; 1,3-Dibrombenzol
m-Difluorbenzol; 1,3-Difluorbenzol
Synthese von Iodbenzol
Struktur von Fluorbenzol
p-Difluorbenzol; 1,4-Difluorbenzol
1,4-Diiodbenzol; p-Diiodbenzol
Struktur von Brombenzol;
- 1,4-dichlorobenzene; p-dichlorobenzene (en)
- 1,4-Dichlorbenzol, p-Dichlorbenzol (de)
Fluorobenzene
p-Dibrombenzol; 1,4-Dibrombenzol
Struktur von Iodbenzol
Strukturformel von m-Dichlorbenzol
1,3-Diiodbenzol; m-Diiodbenzol
o-Dibrombenzol; 1,2-Dibrombenzol
chlorination of benzene
o-Difluorbenzol; 1,2-Difluorbenzol