Hafnium(IV)-iodid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||
| _ Hf4+ _ I− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Hafnium(IV)-iodid | |||||||||||||||
| Andere Namen | Hafniumtetraiodid | |||||||||||||||
| Verhältnisformel | HfI4 | |||||||||||||||
| Kurzbeschreibung | gelboranger Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 686,11 g·mol−1 | |||||||||||||||
| Aggregatzustand | fest[2] | |||||||||||||||
| Dichte | 5,6 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Hafnium(IV)-iodid ist eine anorganische chemische Verbindung des Hafniums aus der Gruppe der Iodide.
Gewinnung und Darstellung
Hafnium(IV)-iodid kann durch Reaktion von Hafnium mit Iod[1]
oder durch Reaktion von Hafnium(IV)-chlorid mit Aluminiumiodid gewonnen werden.[1]
Eigenschaften
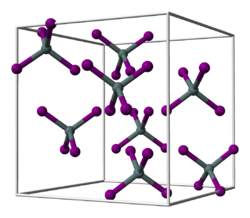
Hafnium(IV)-iodid ist ein gelboranger Feststoff, der in Wasser zu Hafniumoxidiodid hydrolysiert[3] und eine Kristallstruktur vom Zinn(IV)-iodid-Typ mit der Raumgruppe Pa3 (Raumgruppen-Nr. 205)[4] besitzt.[1] Es sublimiert bei 393 °C.[5]
Verwendung
Hafnium(IV)-iodid wird zur Herstellung von reinem Hafnium verwendet.[6] So wurde 1925 die erste Probe reinen Hafniums durch Pyrolyse von Hafnium(IV)-iodid gewonnen.[7]
Einzelnachweise
- ↑ a b c d e Georg Brauer (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearb. Auflage. Band II. Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 1360.
- ↑ a b c d Datenblatt Hafnium(IV) iodide, anhydrous, 99% bei Sigma-Aldrich, abgerufen am 4. Mai 2013 (PDF).
- ↑ Alan George Sharpe: Inorganic chemistry. [Hauptbd.] Pearson Education, 2005, ISBN 978-0-13-039913-7, S. 652 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 478 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. Taylor & Francis US, 2011, ISBN 1-4398-1462-7, S. 194 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Mark T. Swihart, Mark Donald Allendorf, M. Meyyappan: Fundamental Gas-Phase and Surface Chemistry of Vapor-Phase Deposition II and ... The Electrochemical Society, 2001, ISBN 978-1-56677-319-5, S. 153 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Z. Guide to the Elements: Nature's Building Blocks: An A. Oxford University Press, 2001, ISBN 0-19-850341-5, S. 173 (eingeschränkte Vorschau in der Google-Buchsuche).
Auf dieser Seite verwendete Medien
Globales Harmonisiertes System zur Einstufung und Kennzeichnung von Chemikalien (GHS) Piktogramm für gesundheitsgefährdende Stoffe.
Ball-and-stick model of the unit cell of tin tetraiodide, SnI4. X-ray crystallographic data from F. Meller and I. Fankuchen (1955). "The crystal structure of tin tetraiodide". Acta Crystallographica 8: 343-344. DOI:10.1107/S0365110X55001035.


