Gephyrin
| Gephyrin | ||
|---|---|---|
 | ||
Vorhandene Strukturdaten: 1JLJ | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 736 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homotrimer | |
| Kofaktor | Magnesium | |
| Isoformen | 2 | |
| Bezeichner | ||
| Gen-Name | GPHN | |
| Externe IDs | ||
| Enzymklassifikationen | ||
| EC, Kategorie | 2.7.7.5, Transferase | |
| Reaktionsart | Übertragung eines AMP-Rests | |
| Substrat | Molybdopterin(Cu) + ATP | |
| Produkte | Adenylylmolybdopterin + PPi | |
| EC, Kategorie | 2.10.1.1, Transferase | |
| Reaktionsart | Übertragung eines Molybdän-Ions | |
| Substrat | Adenylylmolybdopterin + Molybdat | |
| Produkte | Molybdän-Cofaktor (desulfuriert) + AMP | |
| Vorkommen | ||
| Homologie-Familie | Hovergen | |
| Übergeordnetes Taxon | Eukaryoten | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 10243 | 268566 |
| Ensembl | ENSG00000171723 | ENSMUSG00000047454 |
| UniProt | Q9NQX3 | Q8BUV3 |
| Refseq (mRNA) | NM_001024218 | NM_145965 |
| Refseq (Protein) | NP_001019389 | NP_666077 |
| Genlocus | Chr 14: 66.51 – 67.18 Mb | Chr 12: 78.23 – 78.68 Mb |
| PubMed-Suche | 10243 | 268566 |
Gephyrin ist ein multifunktionelles Enzym in allen Eukaryoten, das zwei Schritte der Molybdän-Cofaktor-Biosynthese katalysiert.[1] Es fungiert außerdem in Tieren als Strukturprotein in inhibitorischen Postsynapsen. Mutationen im GPHN-Gen des Menschen können zum Enzymmangel und so zur seltenen Erbkrankheit Molybdän-Cofaktor-Defizienz führen.
Katalysierte Reaktionen
Insgesamt wird die folgende Reaktion katalysiert, der Zwischenschritt nicht angezeigt:
 + ATP + MoO42−
+ ATP + MoO42−
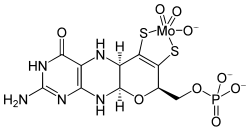 + AMP + PPi + Cu2+
+ AMP + PPi + Cu2+
Molybdopterin(Cu) wird mit Molybdat zu MoCo umgesetzt, ATP wird verbraucht. Der MoCo ist desulfuriert und kann so nur von speziellen Enzymen verwendet werden.
Funktion in der Zellstruktur
Analog dem PSD-95 an exzitatorischen Synapsen gilt Gephyrin als entscheidendes Gerüstelement für die Organisation der Postsynapse. Entdeckt wurde Gephyrin durch seine Bindung an Glycinrezeptoren, die vor allem in Rückenmark und Hirnstamm Nervenzellen hemmen. Es bindet aber auch direkt an GABA-Rezeptoren, die wichtigsten inhibitorischen Rezeptoren im sonstigen Zentralnervensystem.
In Zellen liegt Gephyrin meist als Oligomer vor, die Basis scheint eine trimere Konformation zu sein. Verschiedene Spleiß-Varianten verhindern diese Oligomerisierung, ohne die Bindung an die Rezeptoren zu beeinflussen. Sie stören trotzdem die Zusammensetzung der inhibitorischen Postsynapse und können eine Rolle bei Krankheiten wie etwa Epilepsie spielen.
So ändern sich in manchen Formen der experimentell herbeigeführten Epilepsie die Gephyrin-Level deutlich. Völliger Gephyrin-Mangel führt im Tiermodell zu steifen Muskeln und zum Tod direkt nach der Geburt. Steife Muskeln sind auch ein Symptom der Hyperekplexie und des Stiff-Person-Syndroms, sie werden bei beiden Krankheiten nicht ausreichend gehemmt. Ursache können eine Mutation im Gephyrin-Gen sein beziehungsweise die Ausschaltung des Proteins durch Auto-Antikörper.
Literatur
- V. Tretter, J. Mukherjee u. a.: Gephyrin, the enigmatic organizer at GABAergic synapses. In: Frontiers in cellular neuroscience. Band 6, 2012, S. 23, doi:10.3389/fncel.2012.00023. PMID 22615685. PMC 3351755 (freier Volltext).
Einzelnachweise
Weblinks
Auf dieser Seite verwendete Medien
Metal-binding pterin (MPT), a precursor of MPT-AMP in the biosynthesis of the molybdenum cofactor (MoCo)
Molybdän-Cofaktor, hierbei ist Molybdän mit Molybdopterin komplexiert
Autor/Urheber: Emw, Lizenz: CC BY-SA 3.0
Structure of the GPHN protein. Based on PyMOL rendering of PDB 1ihc.


