Genomgröße
Die Genomgröße bezeichnet die Gesamtmenge an DNA in einer Kopie des Genoms.
Eigenschaften

Die Genomgröße wird entweder in Picogramm, Dalton oder in Kilo- (kb) bzw. Megabasenpaaren (Mbp) angegeben. Ein Picogramm entspricht 978 Megabasenpaaren.[2] Bei diploiden Genomen entspricht die Genomgröße konventionsgemäß dem C-Wert, d. h., es wird haploid betrachtet.[3]
Das C-Wert-Paradoxon beschreibt den fehlenden linearen Zusammenhang zwischen DNA-Menge und der Komplexität eines Lebewesens bei Eukaryoten, der sich aus einer variierender Menge nichtcodierender DNA ergibt. Es gibt eine gewisse lineare Korrelation bei Bakterien, Archaeen, Viren und Organellen, nicht aber bei Eukaryoten.[4] Weiterhin gibt es eine gewisse Korrelation mit der Zellgröße, der Zellteilungsrate, und innerhalb einzelner Taxa auch weitere Parameter.[5][6] Daneben gibt es einen Zusammenhang zwischen der Genomgröße und der Chromatinkondensation.[7] Weitere Parameter zur Beschreibung eines Genoms sind die Gendichte und der GC-Anteil. Während bei der Entwicklung des Lebens eine generelle Tendenz zur Zunahme der Genomgröße mit der Zeit auftritt, sind die Reiche unter den Tieren mit den größten Genomen die Fische mit den Lungenfischen (142 pg, entsprechend 139.000 MB) und die Amphibien mit den Salamandern (83 pg, entsprechend 81.000 MB),[8]
Die Genomgröße in Tieren variiert um den Faktor 3.300 und bei Pflanzen um den Faktor 2.300.[9][6]
| Art | Größe (Mbp) | Anzahl | Dichte (Gene/Mbp) | Anmerkungen |
|---|---|---|---|---|
| Porcines Circovirus-1[10] | 0,001759 | 2 | 1.137 | kleinstes Genom eines autonom replizierenden Virus. |
| Carsonella ruddii[11] | 0,16 | 182 | 1.138 | kleinstes Genom eines Lebewesens, endosymbiontisches Bakterium |
| Nanoarchaeum equitans[12] | 0,49 | 536 | 914 | Archaee, parasitär |
| Mycoplasma genitalium[13] | 0,58 | 800 | 860 | Bakterium |
| Streptococcus pneumoniae[13] | 2,2 | 2.300 | 1.060 | Bakterium |
| Escherichia coli K12[13] | 4,6 | 4.400 | 950 | Bakterium |
| Saccharomyces cerevisiae[14] | 12,05 | 6.213 | 516 | Hefe, erster Pilz, dessen Genom 1996 vollständig sequenziert wurde |
| Schizosaccharomyces pombe[13] | 12 | 4.900 | 410 | Hefe |
| Plasmodium falciparum[14] | 22,85 | 5.268 | 231 | Erreger der Malaria |
| Entamoeba histolytica[14] | 23,75 | 9.938 | 418 | Amöbe |
| Trypanosoma spp.[14] | 39,2 | 10.000 | 255 | Flagellat |
| Tetrahymena thermophilus[13] | 125 | 27.000 | 220 | Protist |
| Aspergillus nidulans[14] | 30,07 | 9.541 | 317 | Schimmelpilz |
| Neurospora crassa[14] | 38,64 | 10.082 | 261 | Schimmelpilz |
| Caenorhabditis elegans[13] | 103 | 20.000 | 190 | Fadenwurm |
| Drosophila melanogaster[13] | 180 | 14.700 | 82 | Taufliege |
| Locusta migratoria[13] | 5.000 | Heuschrecke | ||
| Takifugu rubripes[13] | 393 | 22.000 | 56 | Kugelfisch |
| Bankivahuhn Gallus gallus[14] | 1.050 | 21.500 | 20,5 | Huhn |
| Homo sapiens[13] | 3.200 | 20.000 | 6,25 | Mensch |
| Mus musculus[13] | 2.600 | 22.000 | 8,5 | Hausmaus |
| Arabidopsis thaliana[13] | 120 | 26.500 | 220 | Pflanze |
| Oryza sativa[14] | 466 | 60.256 | 129 | Reis |
| Zea mays[13] | 2.200 | 45.000 | 20 | Mais |
| Picea glauca[15] | 20.800 | 56.064 | 2,7 | Fichte |
| Lepidosiren paradoxa[7] | 78.400 | Lungenfisch | ||
| Protopterus aethiopicus[16] | 139.000 | größtes tierisches Genom, Lungenfisch | ||
| Paris japonica[17] | 150.000 | größtes Blütenpflanzengenom, Einbeere | ||
| Tmesipteris oblanceolata[18] | 160.450 | größtes Eukaryotengenom, Stand 04.06.2024 |
Die Genomgröße wird an einer Zellkultur mit anschließender Feulgenreaktion unter einem Lichtmikroskop betrachtet und per Software ausgezählt[19] oder per Durchflusszytometrie bestimmt.
Für kleine Genome (DNA-Viren, Einzeller) wurde im Jahr 1991 von John W. Drake ein reziproker Zusammenhang zwischen der Mutationsrate und der Genomgröße postuliert.[20] Bei RNA-Viren ist die tendenziell noch kleinere Genomgröße ein Kompromiss zwischen der Mutationsrate und der Anzahl an Genen (Eigen-Paradoxon).[21] Die RNA-Polymerasen von RNA-Viren besitzen keine Fehlerkorrekturfunktion (kein proof-reading), wodurch die Genomgröße begrenzt wird. Eine Ausnahme bilden die Nidovirales, die eine proof-reading-Funktion mit der Exoribonuklease ExoN aufweisen, wodurch die Genomgröße weniger begrenzt wird.[22]
Umrechnung
oder umgestellt:
Weblinks
Einzelnachweise
- ↑ Eugene V. Koonin: The Logic of Chance: The Nature and Origin of Biological Evolution. FT Press, 2011. ISBN 978-0-13-254249-4.
- ↑ a b Dolezel J, Bartoš J, Voglmayr H, Greilhuber J, Bartos, Voglmayr, Greilhuber: Nuclear DNA content and genome size of trout and human. In: Cytometry Part A. 51. Jahrgang, Nr. 2, 2003, S. 127–128, doi:10.1002/cyto.a.10013, PMID 12541287 (englisch).
- ↑ S. Ohno: The Number of Genes in the Mammalian Genome and the Need for Master Regulatory Genes. In: Major Sex-Determining Genes. Monographs on Endocrinology. Band 11. Springer, Berlin, 1979. ISBN 978-3-642-81261-3. S. 17.
- ↑ Y. Hou, S. Lin: Distinct gene number-genome size relationships for eukaryotes and non-eukaryotes: gene content estimation for dinoflagellate genomes. In: PloS one. Band 4, Nummer 9, September 2009, S. e6978, doi:10.1371/journal.pone.0006978, PMID 19750009, PMC 2737104 (freier Volltext).
- ↑ Bennett MD, Leitch IJ: [[The Evolution of the Genome]]. Hrsg.: T.R. Gregory. Elsevier, San Diego 2005, Genome size evolution in plants, S. 89–162 (englisch).
- ↑ a b Gregory TR: [[The Evolution of the Genome]]. Hrsg.: T.R. Gregory. Elsevier, San Diego 2005, Genome size evolution in animals, S. 3–87 (englisch).
- ↑ a b Alexander E. Vinogradov: Genome size and chromatin condensation in vertebrates. In: Chromosoma. 113, 2005, S. 362, doi:10.1007/s00412-004-0323-3.
- ↑ John Bernard: The Eukaryote Genome in Development and Evolution. Springer Science & Business Media, 2012, ISBN 978-94-011-5991-3, S. 281.
- ↑ Johann Greilhuber: Plant Genome Diversity Volume 2. Springer Science & Business Media, 2012, ISBN 978-3-7091-1160-4, S. 323.
- ↑ National Center for Biotechnology Information: Porcine circovirus 1 isolate PCV1-Eng-1970, complete genome GenBank: KJ408798.1. In: Genbank. Abgerufen am 24. Januar 2018 (englisch).
- ↑ A. Nakabachi, A. Yamashita, H. Toh, H. Ishikawa, H. E. Dunbar, N. A. Moran, M. Hattori: The 160-kilobase genome of the bacterial endosymbiont Carsonella. In: Science. Band 314, Nummer 5797, Oktober 2006, S. 267, doi:10.1126/science.1134196, PMID 17038615.
- ↑ S. Das, S. Paul, S. K. Bag, C. Dutta: Analysis of Nanoarchaeum equitans genome and proteome composition: indications for hyperthermophilic and parasitic adaptation. In: BMC genomics. Band 7, Juli 2006, S. 186, doi:10.1186/1471-2164-7-186, PMID 16869956, PMC 1574309 (freier Volltext).
- ↑ a b c d e f g h i j k l m James D. Watson: Molekularbiologie. Pearson Deutschland GmbH, 2011, ISBN 978-3-86894-029-9, S. 172–175.
- ↑ a b c d e f g h Antonio Fontdevila: The Dynamic Genome. OUP Oxford, 2011, ISBN 978-0-19-954137-9, S. 7.
- ↑ I. Birol, A. Raymond, S. D. Jackman, S. Pleasance, R. Coope, G. A. Taylor, M. M. Yuen, C. I. Keeling, D. Brand, B. P. Vandervalk, H. Kirk, P. Pandoh, R. A. Moore, Y. Zhao, A. J. Mungall, B. Jaquish, A. Yanchuk, C. Ritland, B. Boyle, J. Bousquet, K. Ritland, J. Mackay, J. Bohlmann, S. J. Jones: Assembling the 20 Gb white spruce (Picea glauca) genome from whole-genome shotgun sequencing data. In: Bioinformatics. Band 29, Nummer 12, Juni 2013, S. 1492–1497, doi:10.1093/bioinformatics/btt178, PMID 23698863, PMC 3673215 (freier Volltext).
- ↑ Northcutt RG. 1987. Lungfish neural characters and their bearing on sarcopterygian phylogeny. In The biology and evolution of lungfishes (ed. Bemis WE et al.), pp. 277–297. Alan R. Liss, New York.
- ↑ J Pellicer, M Fay, I Leitch: The largest eukaryotic genome of them all? In: Botanical Journal of the Linnean Society. 164. Jahrgang, Nr. 1, 2010, S. 10–15, doi:10.1111/j.1095-8339.2010.01072.x, PMID 16127452 (englisch, oup.com).
- ↑ Pol Fernández, Rémy Amice, David Bruy, Maarten J.M. Christenhusz, Ilia J. Leitch, Andrew L. Leitch, Lisa Pokorny, Oriane Hidalgo, Jaume Pellicer: A 160 Gbp fork fern genome shatters size record for eukaryotes. In: iScience. Mai 2024, ISSN 2589-0042, S. 109889, doi:10.1016/j.isci.2024.109889 (englisch).
- ↑ D. C. Hardie, T. R. Gregory, P. D. Hebert: From pixels to picograms: a beginners' guide to genome quantification by Feulgen image analysis densitometry. In: The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. Band 50, Nummer 6, Juni 2002, S. 735–749, doi:10.1177/002215540205000601, PMID 12019291.
- ↑ J W Drake: A constant rate of spontaneous mutation in DNA-based microbes. In: Proc Natl Acad Sci USA. 88. Jahrgang, 1991, S. 7160–7164, doi:10.1073/pnas.88.16.7160, PMID 1831267, PMC 52253 (freier Volltext) – (englisch).
- ↑ A Kun, M Santos, E Szathmary: Real ribozymes suggest a relaxed error threshold. In: Nat Genet. 37. Jahrgang, 2005, S. 1008–1011, doi:10.1038/ng1621, PMID 16127452 (englisch).
- ↑ C Lauber, JJ Goeman, C Parquet Mdel, P Thi Nga, EJ Snijder, K Morita, AE Gorbalenya: The footprint of genome architecture in the largest genome expansion in RNA viruses. In: PLoS Pathog. 9. Jahrgang, Nr. 7, Juli 2013, S. e1003500, doi:10.1371/journal.ppat.1003500 (englisch).
Auf dieser Seite verwendete Medien
A highly resolved Tree Of Life, based on completely sequenced genomes.[1] Created using http://itol.embl.de/itol.cgi. Full tree of life was generated including "Genome size" dataset, then exported to SVG. Edited in Inkscape v. 0.46 to remove key and viewbox, then resize page to entire image.
Autor/Urheber: smsaladi, Lizenz: CC BY-SA 4.0
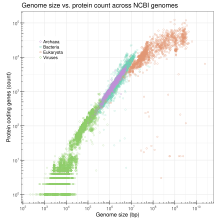
A log-log plot of the total number of annotated proteins in genomes submitted to GenBank as a function of genome size (based on data provided by NCBI genome reports). Up-to-date version: https://saladi.shinyapps.io/Genome_size_vs_protein_count/ Source code: https://github.com/smsaladi/genome_size_vs_gene_count doi:10.22002/D1.1093
(c) Abizar in der Wikipedia auf Englisch, CC BY-SA 3.0
Graph of variation in estimated genome sizes in base pairs