Furocumarine
Furocumarine (auch Furanocumarine) kommen häufig in Doldenblütlern vor wie Bärenklau (Riesen-Bärenklau, Wiesen-Bärenklau) und Arznei-Engelwurz, außerdem in Rautengewächsen wie Zitruspflanzen (darunter Bergamotte, Zitrone, Limette, Grapefruit, Bitterorange u. a.) sowie in einer Reihe weiterer Pflanzen. Furocumarine gehören zu den sekundären Pflanzenstoffen und dienen als Phytoalexine (ein Typ Abwehrstoffe).
Struktur

Die Furocumarine leiten sich strukturell von Cumarin durch Anellierung mit einem Furanring ab. Cumarin besitzt vier Bindungen über die eine Anellierung eines Furanrings möglich ist und ein Furanring lässt sich über seine Bindung zwischen C2 und C3 in zwei unterschiedlichen Orientierungen mit jeder dieser Bindungen verknüpfen. Daraus ergeben sich im Prinzip 8 Grundtypen der Furocumarine, von denen vor allem die vier Stammverbindungen Psoralen, Angelicin, Allopsoralen und Furo[3,2-c]cumarin bzw. deren Derivate natürlich vorkommen.[1]
Beim Psoralen-Typ ist der Furanring mit C6 und C7 des Cumarins verknüpft, wobei sich eine lineare Anordnung der drei Ringe ergibt und beim Angelicin-Typ ist der Furanring mit C7 und C8 des Cumarins verknüpft, wobei sich eine gewinkelte Anordnung der drei Ringe ergibt. In beiden Fällen ist das Sauerstoffatom des Furanrings an C7 des Cumarins gebunden, was auf die Biosynthese beider Furocumarine ausgehend von Umbelliferon (7-Hydroxycumarin) zurückgeht.[2]
- Chalepensin
Bekannte Furocumarine des Psoralen- und Angelicin-Typs sind die unsubstituierten Stammverbindungen Psoralen und Angelicin und deren Derivate, bei denen ein oder beide verbleibenden Wasserstoffatome des zentralen Benzolrings durch Methoxygruppen substituiert sind. Beispiele hierfür sind Bergapten und Xanthotoxin (vgl. auch die Übersichten weiter unten).
Aus der Gefransten Raute (Ruta chalepensis) wurden erstmals unter anderem Chalepensin und Chalepin[3][4] isoliert, die eine Isoprenylierung von C3 des 2-Pyronrings des Psoralen-Ringsystems aufweisen.
Biosynthese

Die Biosynthese von Psoralen und Angelicin erfolgt ausgehend von Umbelliferon (7-Hydroxycumarin) in analogen Schritten. Der erste Schritt ist die Isoprenylierung con C6, bei der Biosynthese von Psoralen unter Bildung von Demethylsuberosin bzw. von C8 bei der Biosynthese von Angelicin unter Bildung von Osthenol. Anschließend erfolgt Ringschluss zu (+)-Marmesin bzw. (+)-Columbianetin und danach die Bildung der C–C-Doppelbindung des Furanrings durch oxidative Eliminierung unter Bildung von Aceton und Wasser.[2]
Eigenschaften
Wie die meisten α,β-ungesättigten Carbonylverbindungen sind Furocumarine sehr reaktiv. Unter Einwirkung von Sonnenlicht (UVA- und UVB-Strahlung) werden Furocumarine photoaktiviert. Prominentes Beispiel ist der giftige Saft des Riesen-Bärenklaus (Herkulesstaude). Die darin enthaltenen Furocumarine schädigen den menschlichen Organismus auf zweierlei Weise:
- Photosensibilisierend/Phototoxisch: Gelangen Furocumarine auf die Haut und werden anschließend dem Sonnenlicht (UV-Strahlung) ausgesetzt, kommt es je nach Schwere zu verbrennungsähnlichen Symptomen (Hautrötung, Schwellung, Blasenbildung, Läsionen, Photopigmentierung, Narbenbildung).[5][6] Siehe auch Berloque-Dermatitis, Photodermatitis.
- Krebserregend: Furocumarine gehen unter UV-Einwirkung kovalente Bindungen mit den Pyrimidinbasen der DNA ein, vernetzen so die DNA-Doppelstränge irreversibel miteinander (DNA-Vernetzung) und wirken dadurch krebserregend.[7][8][9]
In der Medizin werden Furocumarine wie Bergapten, Trioxsalen, Xanthotoxin oder Trimethylpsoralen zur Behandlung von Psoriasis im Rahmen der Phototherapie und Photochemotherapie eingesetzt.[6]
Übersicht
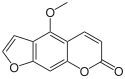
| Psoralen-Typ | |||||
| Bild |  | ||||
| Name | Psoralen | Bergapten | Xanthotoxin | Isopimpinellin | Imperatorin |
| R1 | H | OCH3 | H | OCH3 | H |
| R2 | H | H | OCH3 | OCH3 | O–CH2–CH=C(CH3)2 |
| CAS-Nummer | 66-97-7 | 484-20-8 | 298-81-7 | 482-27-9 | 482-44-0 |
| PubChem | 6199 | 2355 | 4114 | 68079 | 10212 |
| Summenformel | C11H6O3 | C12H8O4 | C12H8O4 | C13H10O5 | C16H14O4 |
| Molare Masse | 186,16 g·mol−1 | 216,19 g·mol−1 | 216,19 g·mol−1 | 246,21 g·mol−1 | 270,28 g·mol−1 |
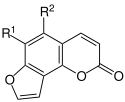
| Angelicin-Typ | ||||
| Bild |  | |||
| Name | Angelicin | Pimpinellin | Isobergapten | Sphondin |
| R1 | H | OCH3 | H | OCH3 |
| R2 | H | OCH3 | OCH3 | H |
| CAS-Nummer | 523-50-2 | 131-12-4 | 482-48-4 | 483-66-9 |
| PubChem | 10658 | 4825 | 68082 | 108104 |
| Summenformel | C11H6O3 | C13H10O5 | C12H8O4 | C12H8O4 |
| Molare Masse | 186,16 g·mol−1 | 246,21 g·mol−1 | 216,19 g·mol−1 | 216,19 g·mol−1 |
Vorkommen in der Natur
Furocumarine vom Psoralen- und Angelicin-Typ kommen in der Natur hauptsächlich in den Pflanzenfamilien Rautengewächse, Doldenblütler, Hülsenfrüchtler und Maulbeergewächse vor. Am häufigsten treten sie in den Rautengewächsen, z. B. in den Zitruspflanzen und den Doldenblütlern, z. B. in den Gattungen Bärenklau und Engelwurzen auf. Bekannte Beispiele sind die Vorkommen in der Grapefruit und im Riesen-Bärenklau.
Die Furocumarine vom Psoralen-Typ sind stärker verbreitet als die vom Angelicin-Typ. Furocumarine vom Angelicin-Typ kommen in den unten genannten Furocumarin-haltigen Pflanzen, die in der menschlichen Ernährung eine Rolle spielen, insbesondere in der Pastinake vor.[11]
- Grapefruit
- Orange
- Zitrone
- Arznei-Engelwurz (Angelica archangelica)
- Riesen-Bärenklau (Heracleum mantegazzianum)
- (c) Christian Fischer, CC BY-SA 3.0Wiesen-Bärenklau (Heracleum sphondylium)
Vorkommen in Früchten, Gemüse und Gewürzen
Typische Lebensmittel, in denen Furocumarine vorkommen sind:[12][11]
- Zitruspflanzen: Grapefruit, Zitrone, Limette, Orange
- Doldenblütler: Karotte, Pastinake, Echter Sellerie, Petersilie, Dill, Echter Koriander, Kreuzkümmel
- Kreuzblütler: Speiserübe
- Maulbeergewächse: Echte Feige
Einzelnachweise
- ↑ Santana, L., Uriarte, E., Roleira, F., Milhazes, N., Borges, F.: Furocoumarins in medicinal chemistry. Synthesis, natural occurrence and biological activity, Current medicinal chemistry, (2004), 11(24), S. 3239–3261
- ↑ a b Bourgaud, F., Hehn, A., Larbat, R., Doerper, S., Gontier, E., Kellner, S., Matern, U.: Biosynthesis of coumarins in plants: a major pathway still to be unravelled for cytochrome P450 enzymes, Phytochemistry Reviews, 2006, 5, S. 293–308
- ↑ R. M. Brooker, J. N. Eble, N. A. Starkovsky: Chalepensin, chalepin and chalepin acetate, three novel furocoumarins from Ruta chalepensis. In: Lloydia. Band 30, 1967, S. 73.
- ↑ Nahar, L., Al-Majmaie, S., Al-Groshi, A., Rasul, A., Sarker, S. D.: Chalepin and chalepensin: Occurrence, biosynthesis and therapeutic potential, Molecules, 2021, 26(6), S. 1609
- ↑ Furanocoumarins as potent chemical defenses.
- ↑ a b Jeannette Aryee-Boi: Dusch-PUVA : Ein innovatives Verfahren der lokalen PUVA-Therapie Klinische und pharmakokinetische Ergebnisse bei Psoriasis vulgaris. Inaugural-Dissertation Freie Universität Berlin, 2002.
- ↑ Oskar Schimmer: Die mutagene und cancerogene Potenz von Furocumarinen. In: Pharmazie in unserer Zeit. Band 10, Nr. 1, 1981, S. 18–28.
- ↑ Eberhart Teuscher: Biogene Gifte. 1987, S. 233.
- ↑ Andreas Herde: Untersuchung der Cumarinmuster in Früchten ausgewählter Apiaceae. (PDF 2,3 MB) Dissertation Universität Hamburg, 2005, S. 29 f.
- ↑ Eintrag zu Furocumarine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Mai 2015.
- ↑ a b Melough, M. M., Cho, E., Chun, O. K.: Furocoumarins: A review of biochemical activities, dietary sources and intake, and potential health risks, Food and chemical toxicology, 2018, 113, S. 99–107
- ↑ Melough, M. M. et al.: Identification and quantitation of furocoumarins in popularly consumed foods in the US using QuEChERS extraction coupled with UPLC-MS/MS analysis, Journal of agricultural and food chemistry, 2017 65(24), S. 5049–5055
Auf dieser Seite verwendete Medien
Autor/Urheber:
- Citrus_paradisi_(Grapefruit,_pink).jpg: א (Aleph)
- derivative work: — raeky
Diese Fotografie zeigt zwei Grapefruits (Citrus ×paradisi) mit rotem Fruchtfleisch, eine davon in Stücke geschnitten.
(c) Christian Fischer, CC BY-SA 3.0
Habitus einer Arznei-Engelwurz (Angelica archangelica).
Chemical diagram for chalepensin (xylotenin; 3-(dimethylallyl)psoralen)
Struktur von Bergapten
Skeletal formula of methoxsalen (xanthotoxin, 8-methoxypsoralen, 8-MOP). Created using ACD/ChemSketch 10.0 and Inkscape.
Autor/Urheber: Mbdortmund, Lizenz: GFDL 1.2
Bochum-Stiepel an der Ruhr - Riesen-Bärenklau (Heracleum mantegazzianum)
Furocumarine Psoralen Typ (Strukturformel)
Autor/Urheber: , Lizenz: CC-0 1.0
Vier Grundtypen der Furocumarine und ihr Bezug zur Struktur des Cumarins
Chemical structure of angelicin created with ChemDraw.
(c) Christian Fischer, CC BY-SA 3.0
Habitus von blühendem Gewöhnlichen Wiesen-Bärenklau (Heracleum sphondylium).
Autor/Urheber: LePoncle, Lizenz: CC0
Biosynthese der Furocumarine Psoralen und Angelicin ausgehend von Umbelliferon
Autor/Urheber:
André Karwath aka Aka
, Lizenz: CC BY-SA 2.5Dieses Bild zeigt eine ganze und eine aufgeschnittene Zitrone.
Furocumarine Angelicin Typ (Strukturformel)