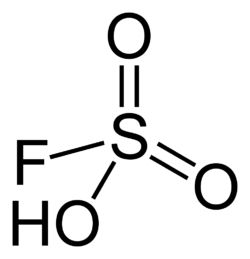
Fluorsulfonsäure
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Fluorsulfonsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | HSO3F | ||||||||||||||||||
| Kurzbeschreibung | farblose, stechend riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 100,06 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | flüssig[1] | ||||||||||||||||||
| Dichte | 1,73 g·cm−3 (15 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | 163 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Fluorsulfonsäure, auch Fluorschwefelsäure, ist eine chemische Verbindung mit der Summenformel HFSO3. Die bei Raumtemperatur farblose Flüssigkeit ist eine der stärksten kommerziell verfügbaren Säuren. Das tetraedrisch aufgebaute Molekül kann auch mit der Konstitutionsformel HOSO2F beschrieben werden, um die Verwandtschaft zur Schwefelsäure (H2SO4) zu betonen.
Geschichte
Fluorsulfonsäure wurde erstmals im Jahr 1892 durch die britischen Chemiker Thomas Edward Thorpe und Walter Kirman aus Schwefeltrioxid und wasserfreien Fluorwasserstoff hergestellt.[3][4]
Gewinnung und Darstellung
Fluorsulfonsäure wird hergestellt durch die Reaktion von Fluorwasserstoff und Schwefeltrioxid oder Chlorsulfonsäure:
Alternativ kann KHF2 oder CaF2 bei 250 °C mit Dischwefelsäure behandelt werden. Einmal befreit von Flusssäure durch Spülung mit einem Inertgas, kann HSO3F in einem Glasgefäß destilliert werden.
Auch die Herstellung durch Reaktion von Kaliumhydrogendifluorid mit Schwefelsäure und Schwefeltrioxid ist möglich.[5]
Chemische Eigenschaften
Fluorsulfonsäure ist löslich in polaren organischen Lösungsmitteln (z. B. Nitrobenzol, Diethylether, Essigsäure und Ethylacetat), aber schlecht löslich in unpolaren Lösungsmittel wie Alkanen. Durch ihre große Stärke löst sie fast alle organischen Verbindungen auf, die auch nur schwache Protonenakzeptoren sind. FSO3H hydrolysiert langsam zu Flusssäure und Schwefelsäure. Sie reagiert bei Raumtemperatur nicht mit S, C, Se, Te, Pb, Ag, Cu, Zn, Fe, Cr, Mn, dagegen reagiert sie mit Zinn. Mit Wasser reagiert sie explosionsartig. Sie ist bis 900 °C thermisch stabil.[5] Die ihr ähnliche Trifluormethansulfonsäure CF3SO3H ist eine ähnlich starke Säure, aber hydrolytisch stabil.
FSO3H ist eine der stärksten bekannten einfachen Brønsted-Säuren, obgleich aktuelle Arbeiten über Carboran-Säuren zu stärkeren Säuren geführt haben. Sie hat einen H0-Wert von −15, verglichen mit −12 für Schwefelsäure. Die Kombination von FSO3H und der Lewis-Säure Antimon(V)-fluorid ergibt „magische Säure“, die eine noch stärkere Säure ist. Diese Säuren werden als „Supersäuren“ bezeichnet (Säuren, die stärker sind als 100%ige Schwefelsäure).[6]
Verwendung
Fluorsulfonsäure wird zur chemischen Synthese von Fluorverbindungen, in der Glasindustrie und als Katalysator für chemische Synthesen verwendet. Sie isomerisiert Alkane und katalysiert die Alkylierung von Kohlenwasserstoffen mit Alkenen. Sie kann auch als Fluorierungsmittel und im Gemisch mit Antimonpentafluorid als besonders starkes Protonierungsmittel (magic acid) verwendet werden.[1]
Sicherheitshinweise
Fluorsulfonsäure ist stark ätzend und greift bei Vorhandensein von Feuchtigkeit oder Wasser Glas und andere siliziumhaltige Materialien sowie die meisten Metalle stark an. Sie hydrolysiert sich unter Abgabe von Flusssäure. Die Zugabe von Wasser zu HSO3F ist ähnlich gefährlich wie die Zugabe von Wasser zu konzentrierter Schwefelsäure. Im Handel ist Fluorsulfonsäure in Behältern aus Monel und Flaschen aus PFA (Perfluoralkoxy) und FEP (Fluorierte Ethylen-Propylen)[7] erhältlich.
Einzelnachweise
- ↑ a b c d e f g h i j Eintrag zu Fluorsulfonsäure in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Eintrag zu Fluorosulphuric acid in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ T. E. Thorpe; W. Kirman: Fluorsulphonic acid in J. Chem. Soc. Trans. 61 (1892) 921–924.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten anorganischer Substanzen, Version 2020, S. 55 (PDF).
- ↑ a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 193.
- ↑ R. J. Gillespie; Fluorosulfuric acid and related superacid media in Acc. Chem. Res. 1 (1968) 202–209.
- ↑ Datenblatt Fluorsulfonsäure, purified by triple-distillation bei Sigma-Aldrich, abgerufen am 14. Mai 2025 (PDF).
Auf dieser Seite verwendete Medien
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for corrosive substances