Fibrodysplasia ossificans progressiva
| Klassifikation nach ICD-10 | |
|---|---|
| M61.1 | Myositis ossificans progressiva Fibrodysplasia ossificans progressiva |
| ICD-10 online (WHO-Version 2019) | |
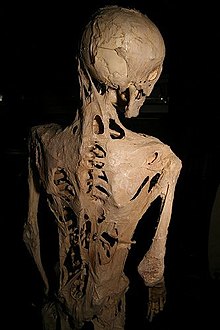
Die Fibrodysplasia ossificans progressiva (kurz FOP), ist eine krankhafte, fortschreitende Verknöcherung des Binde- und Stützgewebes des menschlichen Körpers.[1][2]
Synonyme sind: Fibrodysplasia ossificans multiplex progressiva; Myositis ossificans progressiva; Münchmeyer-Syndrom
Die Bezeichnung Münchmeyer-Syndrom leitet sich von Ernst Münchmeyer her, der die Krankheit 1869 beschrieben hatte.[3][4]
Häufigkeit
Die Krankheit wurde 1692 von Guy Patin erstmals erwähnt. Ein durch die Krankheit versteiftes Skelett wurde auch 1741 von dem Bischof Robert von Cork beschrieben.[5] FOP ist autosomal-dominant vererbbar, allerdings kommt es kaum vor, dass FOP-Kranke Kinder bekommen. Dies führt auch zu der niedrigen Ausbreitung. Weltweit sind der Medizin derzeit etwa 600 Fälle bekannt. Es ist aber von mehreren tausend Fällen weltweit auszugehen. Einer Statistik zufolge ist nur einer unter 2 Millionen betroffen,[1] dies entspräche zurzeit etwa 3250 Menschen. Da FOP zu den seltensten Krankheiten weltweit zählt, war sie lange unerforscht. US-amerikanische Wissenschaftler begannen erst Ende des 20. Jahrhunderts, die Umstände vor allem mit Hilfe der Genforschung zu untersuchen. Große Verdienste an der bisherigen Erforschung der Krankheit haben der Kinderarzt Michael Zasloff und der orthopädische Chirurg Fred Kaplan. 1997 konnten erste Forschungsergebnisse über die Ursache veröffentlicht werden.
Krankheitsursache
Die Krankheit entsteht durch das Fehlen eines Abschaltsignales für ein Gen, welches das Skelettwachstum während der Entwicklung eines Fötus steuert. Hierdurch entwickeln die Fibrozyten bei der Wundheilung Knochen statt normalem Narbengewebe, was selbst bei kleinsten Verletzungen dazu führt, dass sich der Körper langsam versteift.
Bei der klassischen Form liegen Mutationen (617G>A; R206H) im ACVR1/ALK2-Gen auf dem Chromosom 2 Genort q24.1 zugrunde, das für den Activin A-Rezeptor Typ I/für die Activin-ähnliche Kinase 2, einem Bone Morphogenetic Protein (BMP)-Typ I-Rezeptor kodiert.[6] Bei der atypischen Form werden auch heterozygote ACVR1-Missense-Mutationen gefunden.[1][2]
Erkennung/Symptome
Bereits bei Geburt Hallux valgus in 95 %, bei 50 & Verkürzung des Daumens beidseits. Sehr häufig Fehlbildungen der Halswirbelkörper mit Bewegungseinschränkung schon in den ersten Lebensjahren. Hörprobleme treten bei etwa 50 % auf. Mit den entzündlichen Schwellungen, die verknöchern können, sind bevorzugt Gelenke am Kopf, Nacken, Kiefer, arm und Knie betroffen.[1]
Beim Ausbruch der Krankheit werden Bereiche des Körpers aufgebläht und erhitzen sich stark. Die Blutgefäße sind dann deutlich zu erkennen. Nach wenigen Tagen bildet sich das Gewebe wieder zurück. Allerdings ist nun auf Röntgenbildern zu sehen, dass hier neue Knochen entstanden sind.[1]
Diese Knochenneubildungen können sowohl in Schüben (meist im Kindes- und Jugendalter) als auch schleichend (bei Erwachsenen) erfolgen. Es gibt atypische Formen. Entweder liegen zusätzliche Veränderungen wie aplastische Anämie, Kraniopharyngeom, kindliches Glaukom oder Wachstumsverzögerung vor (FOP plus) oder die klassischen Symptome fehlen oder sind durch ungewöhnliche Fehlbildungen ersetzt. (FOP Varianten).[1]
Differentialdiagnose
Abzugrenzen sind:[1]
- Progressive ossäre Heteroplasie[7]
- Osteosarkom
- Lymphödem
- Weichteilsarkom
- Desmoid-Tumor
- aggressive juvenile Fibromatose
- erworbene heterotope Ossifikation
Verlauf
Aufgrund der Umstände ihres Entstehens verläuft diese Krankheit meistens von oben nach unten. Also sind zuerst die Muskeln und das Binde- und Stützgewebe im Hals, Nacken und den Schultern betroffen, später in Armen, Brust, Bauch, Becken bis zu den Beinen und Füßen. Zusätzlich können Verletzungen am Muskelgewebe (zum Beispiel Prellungen, Risse, Schnitte und Einstiche) zusätzlichen Knochenwuchs hervorrufen. Aus diesem Grund ist unbedingt davon abzuraten, intramuskuläre Injektion zu verabreichen oder gar das betroffene Gewebe zu entfernen. Mit fortschreitendem Alter tritt bei den meisten Patienten eine Einschränkung der Lungenfunktion durch die verminderte Brustkorbbeweglichkeit auf.
Therapie/Heilungschancen
Momentan gibt es keine Therapie zur Behandlung und auch keine Möglichkeit zur Verhütung von FOP. Eine kurze Behandlung mit hochdosierten Corticosteroiden über 4 Tage innerhalb der ersten 24 Stunden nach einem Schub kann die Entzündung und das Ödem mindern. Stürze sollten auch durch einen Kopfschutz vermieden werden.[1]
Prognose
Die mittlere Lebensdauer beträgt 40 Jahre. Meist werden Betroffene im Verlauf rollstuhlpflichtig. Die eingeschränkte Beweglichkeit des Brustkorbs ist die häufigste Todesursache.[1]
Siehe auch
Literatur
- Nadine Z. Großmann, Susanne Hildebrandt u. a.: Fibrodysplasia ossificans progressiva– wenn sich plötzlich Knochen im Muskel bilden. In: Monatsschrift Kinderheilkunde., 2023, doi:10.1007/s00112-023-01816-5.
- F. S. Kaplan, M. Le Merrer, D. L. Glaser, R. J. Pignolo, R. E. Goldsby, J. A. Kitterman, J. Groppe, E. M. Shore: Fibrodysplasia ossificans progressiva. In: Best Pract Res Clin Rheumatol., 2008 Mar;22(1), S. 191–205. Review. PMID 18328989
- L. Seefried, D. Banholzer u. a.: Empfehlungen zur Versorgung von Patient:innen mit FOP. In: Die Orthopädie. 2023, doi:10.1007/s00132-023-04425-y.
Weblinks
- emedicine.medscape
- International FOP Association
- BBC Exclusiv - Lebendig versteinert (Münchmeyer-Syndrom FOP)
- Medline Plus
- Rare Diseases
Einzelnachweise
- ↑ a b c d e f g h i Fibrodysplasia ossificans progressiva. In: Orphanet (Datenbank für seltene Krankheiten).
- ↑ a b emedicine.medscape Pediatric FOP
- ↑ Leslie T. Morton, Robert J. Moor: A Chronology of Medicine and Related Sciences. Scolar Press, Aldershot 1997, S. 308.
- ↑ Münchmeyer: Ueber Myositis ossificans progressiva. In: Zeitschrift für rationelle Medicin, 1869, Band 34, S. 9–41 (Digitalisat).
- ↑ Heinrich Buess, Huldrych M. Koelbing: Kurze Geschichte der ankylosierenden Spondylitis und Spondylose. J. R. Geigy, Basel 1964 (= Acta rheumatologica. Nr. 22), S. 36.
- ↑ Fibrodysplasia ossificans progressiva. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ Heteroplasie, progressive ossäre. In: Orphanet (Datenbank für seltene Krankheiten).
Auf dieser Seite verwendete Medien
Autor/Urheber: Joh-co (Diskussion · Beiträge), Lizenz: CC BY-SA 3.0
The skeleton of Harry Raymond Eastlack, a known sufferer of fibrodysplasia ossificans progressiva, a disease which causes damaged soft tissue to regrow as bone. Sufferers are slowly imprisoned by a secondary skeleton.
