Febuxostat
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Febuxostat | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C16H16N2O3S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | M04AA03 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 316,38 g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | 0,2 mg·l−1 in Wasser[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Febuxostat (Handelsname ADENURIC®, Vertrieb Berlin-Chemie/Menarini) ist ein Arzneistoff, der zur Behandlung der chronischen Hyperurikämie bei Erkrankungen, die bereits zu Ablagerungen von Uratkristallen geführt haben (einschließlich eines aus der Krankengeschichte bekannten oder aktuell vorliegenden Gichtknotens und/oder einer Gichtarthritis), zugelassen ist.[4]
Pharmakologie
 |  | |
| Purin | ||
 | ||
| Allopurinol | Febuxostat | |
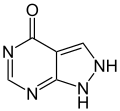
Febuxostat gehört – zusammen mit Allopurinol – zur Wirkstoffgruppe der Urikostatika, ist aber, wie aus der obigen Tabelle ersichtlich, eine komplett unterschiedliche Substanz und kein Purinderivat wie das Allopurinol.
Pharmakodynamik
Als selektiver Hemmer der Xanthinoxidase führt es zu einer verminderten Harnsäurebildung durch nicht-kompetitive Hemmung der Xanthinoxidase, die Hypoxanthin in Xanthin und weiter in Harnsäure oxidiert. Zusätzlich bewirkt die dadurch erhöhte Hypoxanthinkonzentration eine Hemmung der Purinsynthese.[5] Febuxostat ist ein stärker selektiver und wirksamerer Hemmstoff der Xanthinoxidase als Allopurinol. Versuchsergebnisse weisen darauf hin, dass Febuxostat sowohl die oxidierte, als auch die reduzierte Form der Xanthinoxidase hemmt. In einer therapeutischen Konzentration hemmt Febuxostat im Gegensatz zu Allopurinol keine anderen Enzyme des Purin- oder Pyrimidinstoffwechsels (Guanin-Deaminase, Hypoxanthin-Guanin-Phosphoribosyl-Transferase, Orotat-Phosphoribosyl-Transferase, Orotidin-Monophosphat-Decarboxylase oder Purin-Nukleosid-Phosphorylase).
Pharmakokinetik
- Ungefähr 99,2 % von Febuxostat ist an Plasmaproteine gebunden (vorrangig an Albumin).
- Febuxostat wird sowohl durch Syntheseleistungen der Leber und als auch der Nieren eliminiert.
- Die Resorption von Febuxostat ist schnell und hoch (mindestens 84 %).
- Tmax* = 1,0 – 1,5 h
- Nach einfachen oder wiederholten oralen Dosen von Febuxostat 80 und 120 mg einmal pro Tag beträgt die Cmax* ungefähr 2,8–3,2 μg/ml und 5,0–5,3 μg/ml. Die absolute Bioverfügbarkeit der Tablettenformulierung von Febuxostat wurde noch nicht untersucht.
- Die durchschnittliche terminale Eliminationshalbwertszeit (t1/2) von Febuxostat beträgt ca. 5 bis 8 Stunden.
- Der Abbau erfolgt in der Leber über das Uridindiphosphatglucuronyltransferase (UDPGT)-Enzymsystem und das Cytochrom P450 (CYP)-System. Oxidative Metaboliten werden vorwiegend durch CYP1A1, CYP1A2, CYP2C8 oder CYP2C9 gebildet und Febuxostatglucuronid hauptsächlich durch UGT1A1, 1A8 und 1A9.
- Die Elimination erfolgt zu etwa gleichen Teilen sowohl über die Leber als auch über die Niere.
Bei leichter bis mittelschwerer Beeinträchtigung der Nierenfunktion (Kreatininclearence 30 – 80 ml/min) ist keine Dosisanpassung erforderlich. Weder Alter noch Geschlecht üben einen signifikanten Einfluss auf Pharmakokinetik von Febuxostat aus, sodass auch bei Patienten über 65 Jahre keine Dosisanpassung erfolgen muss. Nach Einnahme mehrerer Dosen von 80 mg Febuxostat bei Patienten mit leichter oder mittelschwerer Leberfunktionseinschränkung veränderte sich die Cmax und AUC nicht signifikant im Vergleich zu Probanden mit normaler Leberfunktion. Es wurden keine Studien bei Patienten mit schwerer Leberfunktionseinschränkung durchgeführt.
Arzneimittelwechselwirkungen
Febuxostat kann ohne Dosisanpassung zusammen mit Colchicin (2× täglich 0,6 mg), mit NSAR wie Naproxen und Indomethacin, Hydrochlorothiazid, Warfarin und Desipramin (CYP2D6-Substrat) angewendet werden. Da Azathioprin und 6-Mercaptopurin über die Xanthinoxidase verstoffwechselt werden und deshalb aus der Komedikation mit Febuxostat schwere Nebenwirkungen möglich sind, wird eine gleichzeitige Anwendung nicht empfohlen.
Wirksamkeit
Febuxostat senkte in einer randomisierten Studie den Harnsäurespiegel zuverlässiger auf Normwerte als Allopurinol. Das Wiederauftreten einer symptomatischen Gicht oder die Reduktion von Gichtablagerungen waren vergleichbar.[6]
Unerwünschte Wirkungen
Als Nebenwirkungen wurden 3,5 % Leberfunktionsstörungen beobachtet. Diese Rate ist unter Allopurinolgabe vergleichbar beobachtet worden. In rund der Hälfte der Fälle mit Leberfunktionsstörungen musste die Therapie abgebrochen werden. Seltenere Nebenwirkungen waren Diarrhoe, Übelkeit und allergischer Hautausschlag. Eine erhöhte Rate von kardialen Ereignissen konnte bisher nicht bestätigt werden.[7] Das unter Allopurinol sehr selten beobachtete Stevens-Johnson-Syndrom ist in den Zulassungsstudien bei Febuxostat nicht aufgetreten.[7] Nach Marktzulassung kam es allerdings selten zu schweren Hypersensitivitätsreaktionen einschließlich des Stevens-Johnson-Syndroms. Eine Häufung bei Patienten mit bereits stattgehabten allergischen Reaktionen auf Allopurinol wurde beobachtet.[8]
Bereits in den Zulassungsstudien waren im Vergleich zu Allopurinol häufigere kardiovaskuläre Ereignisse unter Febuxostat aufgefallen. Dies führte zu einem entsprechenden Warnhinweis in den deutschen Fachinformationen. Im November 2017 hat auch die US-amerikanische Arzneimittelbehörde (FDA) auf ein erhöhtes Risiko für kardiale Todesfälle hingewiesen und eine Untersuchung angekündigt[9]. Der Hersteller von Febuxostat wurde von der Europäischen Arzneimittel-Agentur (EMA) und der FDA verpflichtet, die kardiovaskuläre Sicherheit von Febuxostat in einer prospektiven randomisierten Studie zu untersuchen. In diese sog. CARES-Studie wurden mehr als 6000 Patienten mit Gicht und bedeutsamen kardiovaskulären Vorerkrankungen eingeschlossen. Es zeigte sich im Vergleich zu einer Behandlung mit Allopurinol, dass sowohl die Gesamtletalität (7,8 % vs. 6,4 %) wie auch die Letalität aufgrund kardiovaskulärer Erkrankungen (4,3 % vs. 3,2 %) unter Febuxostat signifikant höher war (HR: 1,22 bzw. HR: 1,34).[10] Der Arzneimittelbrief mahnt daher zu einem sehr zurückhaltenden Einsatz von Febuxostat, insbesondere bei Patienten mit hohem kardiovaskulärem Risiko[11]. Im November 2020 wurden die Daten der vor demselben Hintergrund durchgeführten europäischen „FAST-Studie“ publiziert. Sie zeigten keine erhöhte Rate von schweren kardiovaskulären Ereignissen oder der Gesamtletalität von Febuxostat gegenüber Allopurinol.[12]
Literatur
- M. A. Becker, H. R. Schumacher, R. L. Wortmann, P. A. MacDonald, D. Eustace, W. A. Palo, J. Streit, N. Joseph-Ridge: Febuxostat compared with Allopurinol in Patients with Hyperuricemia and Gout. In: N Engl J Med., 353, 2005, S. 2450–2461.
- M. A. Becker, H. R. Schumacher, R. L. Espinoza, A. F. Wells, B. Hunt, P. A. MacDonald, E. Lloyd, C. Lademacher: The urat-lowering efficacy and safety of Febuxostat in the treatment of the hyeruricemia of Gout: The CONFIRMS trial. In: Arthritis Research & Therapy, 12, 2010, S. R63. doi:10.1186/ar2978
- N. L. Edwards: Febuxostat: A new treatment for hyperuricemia in gout. In: Rheumatology, Vol. 48 Nr. 1 2009, S. ii15-ii19
- K. Okamoto, B. T. Eger, T. Nishino, S. Kondo, E. F. Pai, T. Nishino: An extremely potent inhibitor of xanthine oxidoreductase. Crystal structure of the enzyme-inhibitor complex and mechanism of inhibition. In: The Journal of Biological Chemistry. Band 278, Nr. 3, Januar 2003, S. 1848–1855, PMID 12421831 (jbc.org [PDF]).
- H. R. Schumacher, M. A. Becker, R. L. Wortmann, P. A. MacDonald, B. Hunt, J. Streit, C. Lademacher, N. Joseph-Ridge: Effects of Febuxostat versus Allopurinol and Placebo in Reducing Serum Urate in Subjects with Hyeruricemia and Gout: A 28-Week, Phase III, Randomized, Double-Blind, Parallel-Group Trial. In: Arthritis Rheum., 59, 2008, S. 1540–1548.
- H. R. Schumacher, M. A. Becker, E. Lloyd, P. A. MacDonald, C. Lademacher: Febuxostat in the treatment of gout: 5-yr findings of the FOCUS efficacy and safety study. In: Rheumatology. Band 48, 2009, S. 188–194, PMID 19141576 (oxfordjournals.org).
- M. A. Becker, H. R. Schumacher, P. A. MacDonald, E. Lloyd, C. Lademacher: Clinical Efficacy and Safety of Successful Longterm Urate Lowering with Febuxostat or Allopurinol in Subjects with Gout. In: J Rheumatol., 36, 2009, S. 1273–1282.
Weblinks
- Artikel über das Medikament. In: Deutsches Ärzteblatt
- Einträge im NIH-Studienregister
- Öffentlicher Beurteilungsbericht (EPAR) der europäischen Arzneimittelagentur (EMA) zu: Febuxostat
- Rote-Hand-Briefe seit Mai 2012 zu Febuxostat
Einzelnachweise
- ↑ a b The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station NJ 2006, ISBN 0-911910-00-X.
- ↑ K. Takács-Novák, M. Urac, P. Horváth, G. Völgyi, B. D. Anderson, A. Avdeef: Equilibrium solubility measurement of compounds with low dissolution rate by Higuchi’s Facilitated Dissolution Method. A validation study. In: Eur. J. Pharm. Sci., 106, 2017, S. 133–144, doi:10.1016/j.ejps.2017.05.064.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 2-(3-Cyano-4-(2-methylpropoxy)phenyl)-4-methylthiazole-5-carboxylic acid im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 10. Februar 2020.
- ↑ M. Hu, B. Tomlinson: Febuxostat in the management of hyperuricemia and chronic gout: a review. In: Therapeutics and Clinical Risk Management. Band 4, Nr. 6, Dezember 2008, S. 1209–1220, PMID 19337428, PMC 2643102 (freier Volltext).
- ↑ M. A. Becker, H. R. Schumacher, R. L. Wortmann u. a.: Febuxostat compared with allopurinol in patients with hyperuricemia and gout. In: The New England Journal of Medicine. Band 353, Nr. 23, Dezember 2005, S. 2450–2461, doi:10.1056/NEJMoa050373, PMID 16339094.
- ↑ M. A. Becker, H. R. Schumacher Jr, R. L. Wortmann, P. A. MacDonald, D. Eustace: Febuxostat compared with allopurinol in patients with hyperuricemia and gout. In: N Engl J Med. 353(23), 8. Dezember 2005, S. 2450–2461. PMID 16339094
- ↑ a b P. Christalla, K. Wittköpper, A. Al-Armouche: Febuxostat, ein neues Pharmakon zur Behandlung der Gicht. In: Der Kardiologe. Januar 2011, S. 45–50.
- ↑ Rote-Hand-Brief Wichtige Informationen zum Zusammenhang des Risikos für schwere Hypersensitivitätsreaktionen, darunter auch Stevens-Johnson-Syndrom und akute anaphylaktische Reaktionen / Schock mit Adenuric® (Febuxostat). 21. Mai 2012, akdae.de (PDF); abgerufen am 27. Mai 2012.
- ↑ Uloric (febuxostat): Drug Safety Communication - FDA to Evaluate Increased Risk of Heart-related Death. In: Drug safety alerts for human medical products. US Food and Drug Administration, 2017, abgerufen am 26. April 2018 (englisch).
- ↑ William B. White, Kenneth G. Saag, Michael A. Becker, Jeffrey S. Borer, Philip B. Gorelick: Cardiovascular Safety of Febuxostat or Allopurinol in Patients with Gout. In: New England Journal of Medicine. Band 378, Nr. 13, S. 1200–1210, doi:10.1056/nejmoa1710895 (nejm.org [abgerufen am 6. April 2018]).
- ↑ Febuxostat: erhöhtes kardiovaskuläres Risiko gegenüber Allopurinol bei Erwachsenen mit Gicht. In: Der Arzneimittelbrief. W. D. Ludwig, J. Schuler, 2018, abgerufen am 26. April 2018.
- ↑ Isla S. Mackenzie, Ian Ford, George Nuki, Jesper Hallas, Christopher J. Hawkey: Long-term cardiovascular safety of febuxostat compared with allopurinol in patients with gout (FAST): a multicentre, prospective, randomised, open-label, non-inferiority trial. In: Lancet (London, England). Band 396, Nr. 10264, 28. November 2020, S. 1745–1757, doi:10.1016/S0140-6736(20)32234-0, PMID 33181081.
Auf dieser Seite verwendete Medien
Allopurinol
Febuxostat_Strukturformal
Struktur von Purin


