Glucose-6-phosphat-Dehydrogenase-Mangel
| Klassifikation nach ICD-10 | |
|---|---|
| D55.0 | Anämie durch Glukose-6-Phosphat-Dehydrogenase[G6PD]-Mangel |
| ICD-10 online (WHO-Version 2019) | |
Der Glucose-6-phosphat-Dehydrogenase-Mangel (kurz: G6PD(H)-Mangel; Synonyme: Favismus, Favabohnen-Krankheit, manchmal auch Fabismus) ist ein angeborener Mangel des Enzyms Glucose-6-phosphat-Dehydrogenase beim Menschen durch Mutation des G6PD-Gens auf dem X-Chromosom, Abschnitt q28 (Xq28). Der Mangel des Enzyms G6PD führt durch Veränderung des Zuckerstoffwechsels zu einer vermehrten Zerstörbarkeit der roten Blutkörperchen (Erythrozyten) durch äußere Faktoren in Form einer Hämolyse. Die Symptome des G6PD-Mangels sind je nach Mutation (allelische Variante) und Geschlecht des Betroffenen hoch variabel: sie reichen von Beschwerdefreiheit bis hin zu einer lebensbedrohlichen hämolytischen Krise. Drei typische Formen sind Beschwerdefreiheit, eine induzierte hämolytische Anämie (hämolytische Krise) und eine chronische hämolytische Anämie mit hämolytischen Krisen. Neugeborene mit einem G6PD-Mangel können eine verlängerte oder besonders ausgeprägte Neugeborenengelbsucht erleiden (Icterus neonatorum). Von den schweren Verlaufsformen sind fast ausschließlich Jungen und Männer betroffen.
Unter Zusammenfassung aller Varianten und Ausprägungen weisen auf der Welt zirka 1,18 Milliarden Menschen irgendeine Form des G6PD-Mangels auf.[1] Vorwiegend wird der G6PD-Mangel in geographischen Regionen angetroffen, in denen Malaria verbreitet war oder ist. In malariafreien Gebieten kommt der G6PD-Mangel ebenfalls vor, ist aber deutlich seltener. Diese Verteilung des G6PD-Mangels stellt einen balancierten Polymorphismus dar: die relative Resistenz der betroffenen Frauen gegenüber Malaria-Infektionen wiegt unter Gesichtspunkten der Evolution den Nachteil der Empfindlichkeit der betroffenen Männer auf. Die Erkrankung wurde im Zusammenhang mit dem Genuss von dicken Bohnen (Fava-Bohne, Ackerbohne, Saubohne) erstmals beobachtet, worauf der alternative Name Favismus zurückführbar ist. Neben den Fava-Bohnen besitzen Substanzen wie Henna oder diverse Medikamente die Eigenschaft, hämolytische Krisen auszulösen. Im Zusammenhang mit der COVID-19-Pandemie wiesen verschiedene medizinische Veröffentlichungen[2][3][4][5] explizit auf Komplikationen mit dem Medikament Hydroxychloroquin hin. Dieses könne zu Hämolyse sowie Mikroembolien[6][7][8] und damit zum Tod führen.
Die Behandlung des G6PD-Mangels richtet sich nach der vorliegenden Form und dem Betroffenen. Für ausnahmslos alle Betroffenen ist das Wissen um den G6PD-Mangel entscheidend, da somit auslösende Faktoren einer hämolytischen Krise wie Fava-Bohnen oder bestimmte Medikamente vermieden werden können. Bei einer hämolytischen Krise sind sofortige Vermeidung oder Entfernung des Auslösers entscheidend; Bluttransfusionen können in seltenen Fällen erforderlich sein. Die Prognose des G6PD-Mangels hängt von der vorhandenen Form des G6PD-Mangels ab: Sie ist insgesamt gut, bei vorhandener Aufklärung der Betroffenen und leichter Form des G6PD-Mangels sehr gut und geht nicht mit einer verminderten Lebenserwartung einher. Menschen mit schwerem G6PD-Mangel und häufigen hämolytischen Krisen haben eine höhere Morbidität (Krankheitsanfälligkeit) als Menschen ohne G6PD-Mangel.
Ursache
Normale Funktion von Glucose-6-phosphat-Dehydrogenase (G6PD)

Die Glucose-6-phosphat-Dehydrogenase (G6PD; EC 1.1.1.49) ist ein Enzym mit einer molaren Masse von maximal 59.289 Dalton (Da),[9][10] das 249 bis 515 Aminosäuren umfasst und im Raum ein Homodimer oder Homotetramer bildet. Sie gehört zur Enzymfamilie der Oxidoreduktasen und bildet eine eigene Unterfamilie der Glucose-6-phosphat-Dehydrogenasen. G6PD existiert in zwei Isoformen, einer kurzen und einer langen. Die lange Isoform (515 Aminosäuren) findet sich in Lymphoblasten, Granulozyten und Spermazellen. Die kurze Isoform (249 Aminosäuren) findet sich in der Leber und vor allem in den roten Blutkörperchen (Erythrozyten). Beide Isoformen binden NADP zweifach: einmal am N-terminalen Ende des Enzyms als Kofaktor (zwischen der Aminosäure 27 und 210) und einmal als strukturelles Element am C-terminalen Ende.
Das Enzym G6PD katalysiert die Umwandlung von Glucose-6-phosphat in D-Glucono-1,5-Lakton-6-phosphat (6-Phosphoglucono-δ-lakton) unter Reduktion von NADP+ zu NADPH. NADPH ist Kofaktor des Enzyms Glutathionreduktase. Dessen Substrat Glutathion liegt in seiner oxidierten Form als Dimer mit Sulfidbrücke (GSSG) vor. Glutathionreduktase löst die Sulfidbrücke des Dimers durch Reduktion, sodass zwei Monomere reduziertes Glutathion (GSH) entstehen; hierbei wird NADPH zu NADP+ oxidiert. Glutathion ist ein in fast allen Zellen des Menschen vorkommendes Tripeptid, das als Radikale reagierende Oxidantien reduziert, und daher als Radikalfänger oder auch als Antioxidans bezeichnet wird. Beispiele für im Stoffwechsel vorkommende aggressive Oxidantien sind Sauerstoffradikale, Hydroxyl-Radikale und Wasserstoffperoxid. Bestimmte Medikamente oder deren Stoffwechselintermediate reagieren ebenfalls radikalisch (z. B. Primaquin,[11][12][13] Nitrofurantoin[14] oder Sulfanilamid), ebenso die Alkaloide Vicin und Convicin der Ackerbohne. Die antioxidative Funktion von Glutathion setzt voraus, dass die Substanz im reduzierten Zustand vorliegt.
Das bei Reduktion von Glutathion durch die Glutathionreduktase entstehende NADP+ wird wiederum von der G6PD zu NADPH „recycelt“. In der Bilanz trägt G6PD daher zur Aufrechterhaltung der antioxidativen Kapazität des menschlichen Körpers bei.
Pathomechanismus (Pathophysiologie)
Wenn das Enzym Glucose-6-phosphat-Dehydrogenase (G6PD) durch Veränderungen im G6PD-Gen in seiner Aktivität gemindert oder weniger als normal gebildet wird, bewirken diese Veränderungen eine Verminderung der Umwandlung von NADP in NADPH (wie auch von Glucose-6-phosphat in 6-Phosphoglucono-δ-lacton als Ausgangspunkt für weitere Schritte des Pentosephosphatwegs, s. u.). Die verminderte Umwandlung von NADP in NADPH zieht Konsequenzen im Glutathionstoffwechsel nach sich. Das Enzym Glutathionreduktase, das für die Umwandlung von oxidiertem Glutathion (ohne antioxidative Wirkung) in reduziertes Glutathion (mit antioxidativer Wirkung) unter gleichzeitiger Umwandlung von NADPH in NADP verantwortlich ist, kann aufgrund des Mangels an NADPH diese Reaktion nicht mehr wie gewöhnlich katalysieren. Als Folge dieser verminderten Reduktion von oxidiertem Glutathion sinkt die Menge an reduziertem Glutathion und damit die antioxidative Kapazität des menschlichen Körpers ab. Treten nun Substanzen mit oxidativer Wirkung (Oxidantien) im Körper auf, kann bei stark abgesunkener Menge an reduziertem Glutathion dessen antioxidative Schutzwirkung nicht aufrechterhalten werden: Durch die Oxidantien kommt es zu Schädigungen der Zellbestandteile, insbesondere der Zellmembran, aber auch von Eiweißen, letztlich zur unumkehrbaren Schädigung der betroffenen Zellen und nachfolgend zu ihrem Untergang.
Im Gegensatz zu anderen Zellen des menschlichen Körpers beziehen Erythrozyten ihre Energie fast ausschließlich aus Glucose. 90–95 % der Glucose werden über die Glykolyse zur Gewinnung von ATP und damit Energie benutzt. Die verbleibenden 5–10 % Glucose werden zur Bildung von NADPH durch G6PD und ein weiteres Enzym des Pentosephosphatwegs (6-Phosphogluconat-Dehydrogenase)[15] verwendet. Erythrozyten verfügen nicht in nennenswertem Ausmaß über G6PD-unabhängige Mechanismen zur NADPH-Gewinnung. Ist die Aktivität der G6PD vermindert, sinkt die Menge an NADPH, nachfolgend die Menge an reduziertem Glutathion. Somit verfügt der Erythrozyt über keine hinreichenden antioxidativen Schutzmechanismen mehr. Bei Menschen mit G6PD-Mangel werden durch Einwirkung von Oxidantien die Erythrozyten geschädigt und zerstört (Hämolyse). Bei schnellem Ablauf entspricht der Vorgang einer hämolytischen Krise. Ein so entstandener Mangel an Erythrozyten heißt hämolytische Anämie. Bei langsamem Ablauf entsteht eine hämolytische Anämie leichterer Ausprägung.
Da Erythrozyten auf Sauerstofftransport mittels Bindung an Hämoglobin spezialisiert sind, fallen in ihnen in besonderem Ausmaß Sauerstoffradikale an. Daher sind Erythrozyten bei einem G6PD-Mangel immer in einem gewissen Ausmaß betroffen. Je nach Genmutation und nachfolgender Veränderung des Enzyms G6PD variieren das Ausmaß der Hämolyse und die Verkürzung der Lebensdauer der Erythrozyten. Kompensatorisch wird die Bildung roter Blutkörperchen (Erythropoese) gesteigert, wobei der Kompensation Grenzen gesetzt sind.
Alle bekannten Krankheitserreger der Malaria (z. B. Plasmodium falciparum) machen eine Lebensphase in Erythrozyten durch. Die kürzere Lebensdauer der Erythrozyten bei G6PD-Mangel vermindert daher die Vermehrungs- und Fortpflanzungschance der Erreger. Dieser Zusammenhang wird für die relative schützende Wirkung eines G6PD-Mangels gegen Malaria verantwortlich gemacht.
Vererbung

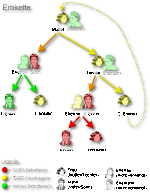
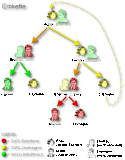
Das Glucose-6-phosphat-Dehydrogenase-Gen (G6PD-Gen) befindet sich auf Abschnitt q28 des X-Chromosoms (Xq28) beim Menschen (DEHUG6 Locus; siehe Bild 3). Daher erfolgt die Vererbung des G6PD-Gens mit dem X-Chromosom (X-chromosomal; siehe Bild 4).
Wird ein verändertes oder krankhaftes G6PD-Gen auf einem X-Chromosom an die Nachkommenschaft (Kinder) weitergegeben, so ist aufgrund der X-chromosomalen Vererbung das Geschlecht der nachkommenden Betroffenen von besonderer Bedeutung. Bei einem weiblichen Nachkommen und Weitergabe eines mutierten G6PD-Gens steht auf dem zweiten X-Chromosom ein gesundes G6PD-Gen zur Verfügung (Heterozygotie). Entsprechend der X-Inaktivierung (Lyon-Hypothese) werden zufällig und ungeordnet (randomisiert) G6PD-Gene mitsamt dem X-Chromosom aktiviert oder deaktiviert. Das deaktivierte X-Chromosom mit dem damit deaktivierten G6PD-Gen kann nicht als Grundlage für die Proteinproduktion fungieren. Entsprechend werden mittels inaktiver defekter G6PD-Gene keine defekten G6PD-Enzyme produziert. Intakte inaktive G6PD-Gene werden ebenfalls nicht zur Synthese von G6PD-Enzym verwendet. Es resultieren bei den so betroffenen weiblichen Individuen zwei Gruppen von Erythrozyten – eine mit verändertem G6PD-Gen und eine mit normalem G6PD-Gen. Je nach Verteilung der beiden Gruppen, die entsprechend der zufällig ablaufenden X-Inaktivierung sehr unterschiedlich ausfallen kann, resultiert bei betroffenen Mädchen und Frauen eine hoch variable und zumeist schwache Merkmalsausprägung des G6PD-Mangels und somit – ebenfalls sehr variabel – wenig bis keine Krankheitszeichen.
Bei männlichen Nachfahren, denen ein X-Chromosom mit Defekten des G6PD-Gens vererbt wird, fehlt das zweite X-Chromosom (männliche Individuen besitzen im Gegensatz zu weiblichen je ein X- und ein Y-Chromosom). Sie sind für die Erkrankung hemizygot. Dies bedingt auch das Ausbleiben der X-Inaktivierung, sodass die Erbinformationen des einzigen X-Chromosoms immer in Proteine übersetzt werden. Bei Vorhandensein eines defekten G6PD-Gens wird somit immer ein entsprechend defektes G6PD-Enzym produziert. Da das Y-Chromosom keine Informationen über G6PD enthält, entsteht bei männlichen Nachkommen immer nur eine Gruppe von Erythrozyten mit defektem G6PD-Enzym. Infolgedessen weisen betroffene Jungen und Männer in aller Regel eine erheblich schwerere Symptomatik als betroffene Mädchen oder Frauen auf, da sie über keine Gruppe von roten Blutkörperchen mit normaler G6PD-Aktivität verfügen. Die Wahrscheinlichkeit, an einem schwerwiegenden G6PD-Mangel zu erkranken, ist für Jungen und Männer somit wesentlich höher als für Mädchen oder Frauen.
Mädchen oder Frauen erkranken nur dann schwerer an einem G6PD-Mangel, wenn beide X-Chromosomen jeweils ein defektes G6PD-Gen aufweisen (homozygot). Dies setzt zwingend voraus, dass sowohl der Vater als auch die Mutter solcher weiblicher Nachkommen eine Mutation des G6PD-Gens aufweisen. Dies ist aber nur selten der Fall.
Varianten des G6PD-Gens
Das Enzym G6PD weist zwei Varianten auf: A und B. Diese Varianten werden durch genetische Änderungen auf DNA-Ebene bedingt. Die resultierenden Eiweiße haben im Gegensatz zu den Mutationen keine krankhafte Funktion. Die A-Variante wird durch Austausch eines DNA-Bausteins (Nukleotid) an Position 376 der DNA des G6PD-Gens definiert (Nukleotidsubstitution). Für das Nukleotid Adenin kommt Guanin zum Einsatz. Dieser Tausch bewirkt eine Änderung der durch diesen DNA-Abschnitt verschlüsselten Aminosäure. Anstelle der Asparaginsäure wird Asparagin verschlüsselt, sodass das resultierende G6PD-Protein entsprechend verändert ist. Die B-Variante hat diese Änderung der DNA-Bausteinabfolge (DNA-Basensequenz) an der Position 376 nicht. Ein wesentlicher Unterschied in der Funktion und Funktionsfähigkeit der beiden Varianten des G6PD-Enzyms besteht ohne das Vorliegen weiterer Veränderungen (Mutationen) nicht.
Die Varianten des G6PD-Enzym haben eine bestimmte geographische Verteilung. Die A-Variante findet sich vorwiegend bei Menschen aus Afrika (alle Regionen südlich der Sahara) und bei Menschen mit afrikanischem Ursprung, wie die afro-amerikanische Bevölkerungsgruppe in den USA. Auch in China ist die A-Variante sehr verbreitet. Die B-Variante ist für den Mittelmeerraum typisch. Sie kommt sowohl in südeuropäischen Bevölkerungsgruppen wie auch in nahöstlichen und nordafrikanischen Bevölkerungsgruppen vor.
Menschen mit der A-Variante von G6PD weisen im Falle einer Mutation des G6PD-Gens – als grobe Regel ausgedrückt – weniger schwere Krankheitszeichen auf als Menschen mit der B-Variante. Es ist aber durchaus möglich und vorkommend, dass Menschen mit einer krankhaften A-Variante der G6PD schwerere Erkrankungszeichen haben als Menschen mit einer krankhaften B-Variante.
Mutationen des G6PD-Gens
Das G6PD-Gen hat eine Größe von zirka 18.000 Basenpaaren (bp) und weist 13 Exons auf. Die Exons kodieren für das 249–515 Aminosäuren umfassende Protein Glucose-6-phosphat-Dehydrogenase (je nach Isoform). Insgesamt sind gegenwärtig (23. September 2006) 149 Mutationen des G6PD-Gens bekannt, molekulargenetisch identifiziert und in der Fachliteratur beschrieben. Davon sind 139 Missense- oder Nonsense-Mutationen, 8 kleine Deletionen, 1 große Deletion und 1 Mutation des Splicings.
Es sind folgende Varianten und Mutationen des G6PD-Gens bekannt und molekulargenetisch beschrieben:
| Beschriebene Mutationen und Varianten der G6PD – Auswahl | |||||||||
| Variante oder Mutation G6PD | Gen | Protein | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Bezeichnung | Kurzname | Isoform G6PD-Protein | OMIM-Code | Typ | Untertyp | Position | Position | Strukturänderung | Funktionsänderung |
| G6PD-A(+) | Gd-A(+) | G6PD A | +305900.0001 | Polymorphismus Nukleotid | A→G | 376 (Exon 5) | 126 | Asparagin→Asparaginsäure (ASN126ASP) | Kein Enzymdefekt (Variante) |
| G6PD-A(-) | Gd-A(-) | G6PD A | +305900.0002 | Substitution Nukleotid | G→A | 376 (Exon 5) und 202 | 68 und 126 | Valin→Methionin (VAL68MET) Asparagin→Asparaginsäure (ASN126ASP) | |
| G6PD-Mediterran | Gd-Med | G6PD B | +305900.0006 | Substitution Nukleotid | C→T | 563 (Exon 6) | 188 | Serin→Phenylalanin (SER188PHE) | Klasse II |
| G6PD-Canton | Gd-Canton | G6PD A | +305900.0021 | Substitution Nukleotid | G→T | 1376 | 459 | Arginin→Leucin (ARG459LEU) | Klasse II |
| G6PD-Chatham | Gd-Chatham | G6PD | +305900.0003 | Substitution Nukleotid | G→A | 1003 | 335 | Alanin→Threonin (ALA335THR) | Klasse II |
| G6PD-Cosenza | Gd-Cosenza | G6PD B | +305900.0059 | Substitution Nukleotid | G→A | 1376 | 459 | Arginin→Prolin (ARG459PRO) | G6PD-Aktivität <10 %, somit hoher Anteil von Kranken. |
| G6PD-Mahidol | Gd-Mahidol | G6PD | +305900.0005 | Substitution Nukleotid | G→A | 487 (Exon 6) | 163 | Glycin→Serin (GLY163SER) | Klasse II |
| G6PD-Orissa | Gd-Orissa | G6PD | +305900.0047 | Substitution Nukleotid | 44 | Alanin→Glycin (ALA44GLY) | NADP-Bindungsstelle betroffen. Höhere Stabilität als andere Varianten. | ||
| G6PD-Asahi | Gd-Asahi | G6PD A- | +305900.0054 | Substitution Nukleotid (mehrere) | A→G ± G→A | 376 (Exon 5) 202 | 126 68 | Asparagin→Asparaginsäure (ASN126ASP) Valin→Methionin (VAL68MET) | Klasse III. |
Epidemiologie (Vorkommen)
Ca. 200 Millionen Menschen sind vom G6PD-Mangel in irgendeiner Form weltweit betroffen. Dabei sind Menschen aus gegenwärtigen oder ehemaligen Malaria-Gebieten deutlich häufiger vom G6PD-Mangel in allen Formen betroffen als Menschen, die nicht aus solchen Regionen stammen. Entsprechend dem Ausbreitungsgebiet der Malaria (sowohl gegenwärtiges als auch vergangenes) finden sich vermehrte Häufigkeiten des G6PD-Mangels in den Tropen und Subtropen. Folgende Regionen sind durch ein vermehrtes Vorkommen des G6PD-Mangels gekennzeichnet:
| Nordamerika | Hier sind die Bevölkerungsgruppen mit afro-amerikanischen oder mittelmeer-europäischen wie auch nahöstlichen und fernöstlichen Abstammungshintergrund betroffen | |
| USA | In der afro-amerikanischen Bevölkerungsgruppe weisen 12,8 % aller Neugeborenen dieser Gruppe einen G6PD-Mangel auf. | [16] |
| Mittelamerika | Alle Bevölkerungsgruppen betroffen | |
| Mexiko | Prävalenz aller G6PD-Formen 0,71 %. | [17] |
| Südamerika | Alle Bevölkerungsgruppen betroffen | |
| Brasilien | Im Bundesstaat Rio Grande do Sul, Neugeborene (n=2799): 1,4 % vollständiger G6PD-Mangel, 6,4 % teilweise G6PD-Mangel, gesamt 7,9 %. | [18] |
| Naher Osten | Alle Bevölkerungsgruppen betroffen. | |
| Abu Dhabi | Neugeborenen-Screening bei 8.198 Neugeborenen: Betroffenen vom G6PD-Mangel sind 9,1 % (746) Neugeborene. | [19] |
| Bahrain | Prävalenz 25 % im Neugeborenen-Screening 1985. | [20] |
| Irak | ||
| Iran | In den iranischen Provinzen Mazandaran und Guilan am Kaspischen Meer beträgt die Prävalenz des G6PD-Mangels 8,6–16,4 %. Folgende Varianten von G6PD wurden dabei vorgefunden: G6PD-Mediterran 66,2 %, G6PD-Chatham 27 % und G6PD-Cosenza bei 6,75 % der Betroffenen. | [21][22] |
| Israel | 806 männliche und weibliche Neugeborene wurden untersucht: 30,2 % aller Jungen und 10,4 % aller Mädchen hatten einen schweren G6PD-Mangel. 14 % der betroffenen Mädchen hatten einen Vater, welcher aus einer Population mit niedriger Prävalenz für den G6PD-Mangel stammt. | [23] |
| Jordanien | Neugeborenen-Screening bei 181 Neugeborenen. 11 % aller weiblichen und 12 % aller männlichen Neugeborenen weisen eine Form des G6PD-Mangels auf. | [24] |
| Libanon | Betroffene Männer 10:1.000, betroffene Frauen 0,4:1.000. Bei Männern über 14 Jahre 36 Betroffene in 3.000 untersuchten Personen (1,2 % oder kumulative Inzidenz 12:1.000). | [25] |
| Zypern | 6,4 % der erwachsenen Männer haben einen G6PD-Mangel: davon haben 52,6 % die mediterrane Mutation 563C->T im Exon 6 (Ser188Phe) des G6PD-Gens. | [26] |
| Südeuropa | Alle Bevölkerungsgruppen betroffen. | |
| Griechenland | 1.286.000 Neugeborene (männlich und weiblich) wurden zwischen 1977 und 1989 untersucht. Ein G6PD-Mangel kam bei 3,14 % aller Untersuchten vor (entspricht 40.349 Betroffene); 1 aus 22 männlichen und 1 aus 54 weiblichen Untersuchten war betroffen. | [27] |
| Italien | Im Neugeborenen-Screening Inzidenz durch Messungen 0,9:1.000, kalkuliert nach Hardy-Weinberg-Gesetz 4,8:1.000. | [28] |
| In der Provinz Cosenza wurde bei 209 von 16.787 Jungen ein G6PD-Mangel vorgefunden (1,24 %). 99 der 209 betroffenen Jungen hatten einen schweren G6PD-Mangel (0,59 %). | [29] | |
| Portugal | 0,51 % von 15.208 Männern haben einen G6PD-Mangel. | [30] |
| Spanien | Neugeborenen-Screening auf G6PD-Mangel in Katalonien: von 3.189 untersuchten Neugeborenen (inklusive Neugeborene mit Migranten-Hintergrund) wiesen 29 eine Form des G6PD-Mangels auf (0,91 %), wobei 3 von 29 erfassten Fällen bei Neugeborenen spanischer Herkunft vorzufinden waren. | [31] |
| In Menorca beträgt die Prävalenz 9,7/1.000 bei Männern (11 Betroffene aus 1139 Untersuchten, entsprechend 0,97 %). | ||
| Nordafrika | Alle Bevölkerungsgruppen betroffen. | |
| Libyen | Bei Männern beträgt die Prävalenz des G6PD-Mangels in Ost-Libyen 2,8 %, bei Frauen 1,8 %. | [32] |
| Tunesien | Bei 325 Untersuchten betrug die Inzidenz des G6PD-Mangels 1,84 %. Unter den Betroffenen wiesen 96,2 % den mediterranen Typ B(+) auf, 1,96 % den afrikanischen Typ A(+). | [33] |
| Asien – Mittlerer Osten und Ferner Osten | Alle Bevölkerungsgruppen betroffen. | |
| Afghanistan | Bei einer Untersuchung an afghanischen Flüchtlingen in Pakistan wiesen 15,8 % der Angehörigen der Bevölkerungsgruppe der Pathan und 7,0–9,1 % der Usbeken eine Form des G6PD-Mangels auf. 2,9 % der Tadschiken und 2,1 % der Turkmenen waren ebenfalls betroffen. | [34] |
| China | In Gesamt-China hatten 6.683 von 155.879 freiwilligen Testpersonen (4,29 %) irgendeine Form des G6PD-Mangels. | [35] |
| Indien | In der Provinz Rajasthan wurde bei 55 von 1.198 Kindern (4,59 %) eine Form des G6PD-Mangels festgestellt. | [36] |
| Indonesien | In Nord-Sumatra wurde bei 6,0 % aller Jungen in der Provinz Nias 3,9 % aller Jungen der Provinz Asahan und 0,9 % aller Jungen in der Stadt Medan eine Form des G6PD-Mangels festgestellt. | [37] |
| Japan | 9.620 Kinder von Überlebenden der Atombombenabwürfe wurden in Hiroshima und Nagasaki untersucht. 0,11 % der männlichen und 0,42 % der weiblichen Kinder in Hiroshima sowie 0,16 % der männlichen und 0,31 % der weiblichen Kinder in Nagasaki hatten eine Form des G6PD-Mangels. Insgesamt wurden 10 Varianten bzw. Veränderungen des G6PD-Enzyms hierbei identifiziert, wobei jeweils 3 neue Varianten in Hiroshima und Nagasaki beschrieben werden konnten. | [38] |
| Malaysia | Neugeborenen-Screening bei 8.975 Neugeborenen zwischen 1985 und 1986 zeigte in der chinesischen Bevölkerungsgruppe eine Inzidenz von 4,5 %, in der malaysischen 3,5 % und in der indischen 1,5 %. | [39] |
| Myanmar (Burma) | Im Bundesstaat (Region) Shan mit Malaria-Endemie 66 von 311 Untersuchten mit G6PD-Mangel entsprechend 21,2 % (Variante G6PD-Mahdiol). | [40] |
| Pakistan | Alle Formen des G6PD-Mangels kommen bei 1,8 % der männlichen Bevölkerung vor (1,07 % in Kaschmiris, 1,47 % in bei Bewohnern des Punjab, 2,77 % bei Sindhis und 3,17 % in Pathanern). | [41] |
| Singapur | Neugeborenen-Screening von zirka 1.600.000 Neugeborenen mit einer Inzidenz von 1,62 % bei allen Neugeborenen (3,15 % bei männlichen, 0,11 % bei weiblichen). | [42] |
| Tadschikistan | Prävalenz 2,1 % (alle Formen des G6PD-Mangels) | [43] |
| Thailand | Prävalenz beim männlichen Geschlecht 3 bis 18 % in Abhängigkeit von der geographischen Region: die häufigste G6PD-Mutation ist G6PD-Mahidol (163Gly→Ser). | [44] |
| Prävalenz bei 505 untersuchten männlichen Neugeborenen beträgt 12,08 %. | [45] | |
| 61 von 505 männlichen Neugeborenen wiesen eine Form des G6PD-Mangels auf. | [46] | |
| Vietnam | Prävalenz in der Bevölkerungsgruppe der Kinh 0,5 % und Mong 0,7 %: beide Gruppen leben nicht in Malaria-Endemiegebieten. In der Bevölkerung, welche in Malaria-Endemiegebieten Vietnams lebt, beträgt die Prävalenz 9,7 bis 31 %. | [47] |
| Afrika (Sub-Sahara) | Alle Bevölkerungsgruppen betroffen | |
| Kenia | Prävalenz im Flachland des Malaria-Endemiegebiets 7 %, im Hochland des Malaria-Endemiegebiets 1 %. | [48] |
| Südafrika | In der Bevölkerungsgruppe mit griechischer Abstammung in Kapstadt konnte bei 6,7 % aller männlichen Untersuchten eine Form des G6PD-Mangels festgestellt werden. | [49] |
| Nord- und Mitteleuropa | Bevölkerungsgruppen mit Migrationshintergrund aus subtropischen und tropischen Regionen betroffen (inkl. Mittelmeerraum) | |
| Frankreich | Im Neugeborenen-Screening 6 % durch G6PD-Mangel betroffene Jungen und 1 % betroffene Mädchen. | [50] |
| Niederlande | 668 schwangere Frauen und 754 gesunde Neugeborene ethnischer Minderheiten in den Niederlanden wurden auf das Vorliegen eines G6PD-Mangels untersucht. Die Prävalenz über alle Gruppen zusammengefasst betrug 6,6 % bei Männern und 5,2 % bei Frauen. Das höchste Vorkommen des G6PD-Mangels fand sich bei Afrikanern sub-saharischer Herkunft (Schwarzafrikanern). | [51] |
Symptome und klinische Formen

Der Glucose-6-phosphat-Dehydrogenase-Mangel verläuft aufgrund seiner unterschiedlichen Formen und Ausprägungen sehr unterschiedlich. Von Bedeutung für das Vorhandensein von Symptomen beziehungsweise die klinische Form sind neben der genetischen Veränderung im G6PD-Gen und dem Geschlecht auch das mögliche Vorhandensein anderer angeborener oder erworbener Bluterkrankungen (Beispiel: Eisenmangelanämie) sowie die Exposition des Betroffenen gegenüber Substanzen, welche eine Hämolyse auslösen können.
Beschwerdefreiheit
Die meisten Mädchen und Frauen mit einem G6PD-Mangel sind im Kindes- und Erwachsenenalter beschwerdefrei. Zwar kann bei diesen Patienten oder Betroffenen mittels Aktivitätsmessung der G6PD in den Erythrozyten eine Aktivitätsminderung festgestellt werden; zu einer Hämolyse mit nachfolgenden klinischen Symptomen wie Gelbsucht (Ikterus), Blutarmut (Anämie), Schwächegefühl (Malaise) oder Kreislaufversagen (in schweren Fällen der Hämolyse) kommt es nicht. Auch wenn Substanzen, die eine Hämolyse auslösen können, eingenommen oder zugeführt werden, tritt eine Hämolyse praktisch nie auf, da die Restaktivität von G6PD zur Verhinderung einer Schädigung (Hämolyse) der Erythrozyten fast immer ausreicht.
Lediglich im Neugeborenenalter kann bei Vorliegen eins Glucose-6-phosphat-Dehydrogenase-Mangels eine verlängerte oder vermehrte Neugeborenengelbsucht (Icterus neonatorum) auftreten, die allerdings nicht zwingend zu einer Erkrankung oder Schädigung des betroffenen Neugeborenen führen muss. Allein auf Basis der Symptome ist ein G6PD-Mangel bedingter verlängerter oder vermehrter Neugeborenenikterus von einem Neugeborenenikterus anderer Ursache nicht zu unterscheiden.
Diagnose
Die Diagnose G6DH-Mangel wird vermutet, wenn Patienten bestimmter ethnischer Gruppen (siehe Epidemiologie), ein oder mehrere folgender Symptome entwickeln (insbesondere, wenn eine „positive Familienanamnese“ besteht, also die Krankheit bei Blutsverwandten bekannt ist):
- Anämie,
- Gelbsucht oder auch andere
- Hämolyse-Symptome
Laborparameter:
- Blutbild und Retikulozytenzahl; bei akutem G6PD-Mangel könnten Heinz-Körper im Blutausstrich zu sehen sein;
- Leberenzyme (zum Ausschluss anderer Ursachen der Gelbsucht);
- Lactatdehydrogenase (erhöht bei Hämolyse und ein Marker des hämolytischen Schweregrads)
- Haptoglobin (erniedrigt bei Hämolyse, da das freie Haptoglobin gemessen wird);
- "unmittelbarer Antiglobulintest" (direkter Coombs-Test) – bei G6DH-Mangel sollte er negativ sein, sonst spricht dies für eine immunologisch induzierter Hämolyse.
Wenn es genügend Gründe gibt G6PD-Mangel zu vermuten, kann der "Beutler-Test" (flurescent spot test) der Diagnosesicherung dienen. Der Beutler-Test ist ein schneller und kostengünstiger Test, welcher durch G6PDH produziertes NADPH unter UV-Licht zeigt. Wenn die Blutzellen nicht fluoreszieren, ist der Test positiv. Der Test kann bei Patienten, die eine akute Hämolyse aus unbekannter Ursache durchmachen, falsch negativ sein. Er ist daher erst 2–3 Wochen nach einer solchen hämolytischen Episode aussagekräftig.
Klassifikation
Entsprechend der gemessenen Funktionsfähigkeit (Enzymaktivität) von G6PD kann der G6PD-Mangel nach der WHO in verschiedene Klassen eingeteilt werden.[52]
| Klasse WHO | Enzymaktivität in Erythrozyten in %Normal | Klinisches Bild |
|---|---|---|
| Klasse 1 | vermindert | chronisch hämolytische Anämie |
| Klasse 2 | < 10 % | schwerer G6PD-Mangel |
| Klasse 3 | 10–60 % | mäßiger G6PD-Mangel |
| Klasse 4 | normale Aktivität (60 %–100 %) | kein G6PD-Mangel |
| Klasse 5 | gesteigerte Aktivität (> 110 %) | kein G6PD-Mangel |
Differentialdiagnose
Der G6PD-Mangel kann aufgrund seiner variablen Symptome und Ausprägungen teilweise nur sehr schwer gegenüber anderen Erkrankungen abgegrenzt werden.
Gelbsucht (Ikterus)
Zwischen der durch einen G6PD-Mangel verursachten Gelbsucht (Ikterus) und anderen Formen der Gelbsucht, die durch andere Umstände und Auslöser verursacht werden, muss unterschieden werden:
- Neugeborenengelbsucht (Ikterus neonatorum)
- Bei der klassischen Neugeborenengelbsucht fehlen die Symptome und Zeichen einer Hämolyse, welche beim G6PD-Mangel anzutreffen sind, in aller Regel.
- Hämolytischer Ikterus des Neugeborenen (Morbus haemolyticus neonatorum)
- Die Unterscheidung zwischen diesem Ikterus und dem des G6PD-Mangels kann sehr schwer sein. Der Morbus haemolyticus neonatorum wird durch einen positiven Coombs-Test bewiesen, welcher den Nachweis für die hämolyse-verursachenden Antikörper führt. Ein negativer Coombs-Test spricht eher für einen G6PD-Mangel; den letztendlichen Beweis kann nur eine Bestimmung der G6PD-Aktivität in den Erythrozyten bewerkstelligen, wobei insbesondere nach Bluttransfusionen bei schweren hämolytischen Krisen dies sehr problematisch sein kann. Alternativ erfolgt eine Genotypisierung des G6PD-Gens.
Hämolytische Anämien
- Angeborene hämolytische Anämie(n) durch Enzymdefekte
- Neben dem G6PD-Mangel existieren noch andere angeborene hämolytische Anämien, welche durch Enzymdefekte verursacht werden. Ein Beispiel für eine solche Anämie ist der Pyruvatkinase-Mangel (PK-Mangel).
- β-Thalassämie (Beta-Thalassämie)
- β-Thalassämien sind ebenfalls angeborene hämolytische Anämien. Im Gegensatz zu den durch Enzymdefekten hervorgerufenen Anämien haben β-Thalassämien ihre Ursache in einer Mutation der β-Kette des Hämoglobins. Sie sind im Gegensatz zum G6PD-Mangel eine Hämoglobinopathie. Bei typischen β-Thalassämien tritt die hämolytische Anämie erst mit 3–9 Monaten in Erscheinung, wenn durch die Umstellung der Hämoglobinsynthese vom fetalen Hämoglobin (HbF) auf das adulte Hämoglobin (HbA) die Mutation in der beta-Kette des Hämoglobins ihre Auswirkungen zeigen kann. Auch ist der Verlauf einer hämolytischen Anämie infolge β-Thalassämie meistens gradueller als die des G6PD-Mangels.
- α-Thalassämie (alpha-Thalassämie)
- Wie β-Thalassämie.
- Autoimmunhämolytische Anämie(n)
- Bei den unterschiedlichen Formen der autoimmunhämolytischen Anämien lassen sich zumeist die Antikörper, welche zur Hämolyse mittels Immunprozessen führen, identifizieren. Dieser Nachweis von Antikörpern ist beim G6PD-Mangel nicht möglich, da die Hämolyse hier durch einen anderen Mechanismus erfolgt.
- Medikamenten-induzierte hämolytische Anämie(n)
- Diese hämolytischen Anämien können sehr schwer von einem G6PD-Mangel zu unterscheiden sein. Ein Hinweis kann die Herkunft des Betroffenen geben, wobei medikamenten-induzierte hämolytische Anämien auch bei Menschen aus Regionen mit G6PD-Mangel vorkommen können. Die sichere Unterscheidung gelingt erst durch die Messung der G6PD-Aktivität.
Andere Anämien
- Eisenmangelanämie
- Diese Anämie geht typischerweise nicht mit einer Hämolyse einher. In aller Regel entwickelt sie sich auch graduell. Typischerweise finden sich kleine Erythrozyten (MCV kleiner 70 fL) und ein Mangel an Eisen und Ferritin im Serum bzw. Plasma.
- Blutungsanämie
- Diese Anämie kann durch Identifizierung einer Blutungsquelle gegenüber der Anämie des G6PD-Mangels abgegrenzt werden. Außerdem weist eine Blutungsanämie in aller Regel keine Zeichen einer Hämolyse auf.
- Folsäuremangelanämie
- Diese Anämie ist charakterisiert durch übernormal große Erythrozyten (MCV größer als 100 fL). Sie entwickelt sich graduell und hat normalerweise keinerlei Hämolysezeichen.
- Vitamin-B12- Mangelanämie
- Diese Anämie ist charakterisiert durch übernormal große Erythrozyten (MCV größer als 100 fL). Sie entwickelt sich graduell und hat normalerweise keinerlei Hämolysezeichen.
Ferner abzugrenzen ist das Kelley-Seegmiller-Syndrom.
Historisches
Der Mangel an Glucose-6-phosphat-Dehydrogenase als Ursache des bereits länger bekannten Krankheitsbild des Favismus beziehungsweise der hämolytischen Anämie infolge Primaquin-Exposition wurden 1956 erstmals identifiziert.[53] Die erste cDNA-Sequenz der G6PD wurde 1981 beschrieben.[54]
Literatur
- R. K. Ohls, R. K. Christensen: Chapter 20. Diseases of the blood. In: R. E. Behrman, R. M. Kliegman, H. B. Jenson: Nelson Textbook of Pediatrics. 17. Auflage. Saunders, Philadelphia 2003, ISBN 0-7216-9556-6.
- M. Recht, H. A. Pearson: Chapter 295. Hemolytic Anemias. In: J. A. McMillan, C. D. Deangelis, R. D. Feigin, J. B. Warshaw, F. A. Oski: Oski’s Pediatrics: Principles and Practice. 3. Auflage. Lippincott Williams & Wilkins, 1999, ISBN 0-7817-1618-7.
Datenbanken
- Glucose-6-phosphat-Dehydrogenase-Mangel. In: Online Mendelian Inheritance in Man. (englisch), Stand 21. Juli 2006, Informationen in Englisch.
- 120731. EntrezProtein des National Center for Biotechnology Information (NCBI), National Library of Medicine (NLM), U.S.A. Datensatz, Stand 19. September 2006 (englisch).
- P11413. SwissProt Datenbank, Universität Genf, Schweiz. Datensatz, Stand 19. September 2006 (englisch).
- G6PD. Human Gene Mutation Database (HGMD), Institute of Medical Genetics, Cardiff, U.K. Datensatz, Stand 23. September 2006 (englisch).
Einzelnachweise
- ↑ Diabetes und Co: Menschheit wird zunehmend multimorbid. In: Deutsches Ärzteblatt, 8. Juni 2015.
- ↑ iss.it: Zusammenhang Hydroxychloroquin und G6PD. (PDF) Abgerufen am 9. Mai 2020.
- ↑ Chloroquine Is Not a Harmless Panacea for COVID-19. 23. März 2020, abgerufen am 9. Mai 2020 (englisch).
- ↑ Deutscher Ärzteverlag GmbH, Redaktion Deutsches Ärzteblatt: Hydroxychloroquin bei COVID-19 möglicherweise mit erhöhter... 22. April 2020, abgerufen am 9. Mai 2020.
- ↑ Glucose-6-phosphat-Dehydrogenase-Mangel - Wissen für Mediziner. Abgerufen am 9. Mai 2020 (deutsch).
- ↑ DIE COVID-19 PANDEMIE UND HÄMOGLOBINERKRANKUNGEN (DE)_Version III ( Upgedated). Abgerufen am 9. Mai 2020 (englisch).
- ↑ Rapporto ISS COVID-19 n. 14/2020 English version - Interim guidance for the appropriate support of people with enzymopenia G6PD (favism) in the current SARS-CoV-2 emergency scenario. Version April 14, 2020 - ISS. Abgerufen am 9. Mai 2020.
- ↑ The Belgian AFMPS warns about risk of hemolysis associated with the use of hydroxychloroquine. Abgerufen am 9. Mai 2020 (englisch).
- ↑ T. Takizawa, I. Y. Huang, T. Ikuta, A. Yoshida: Human glucose-6-phosphate dehydrogenase: primary structure and cDNA cloning. In: Proc Natl Acad Sci U S A., 83(12), 1986, S. 4157–4161.
- ↑ G. Martini, D. Toniolo, T. Vulliamy u. a.: Structural analysis of the X-linked gene encoding human glucose 6-phosphate dehydrogenase. In: EMBO J., 5(8), 1986, S. 1849–1855.
- ↑ R. J. Dern, I. M. Weinstein, G. V. Leroy, D. W. Talmage, A. S. Alving: The hemolytic effect of primaquine. I. The localization of the drug-induced hemolytic defect in primaquine-sensitive individuals. In: J Lab Clin Med., 43(2), 1954, S. 303–309. PMID 13130947.
- ↑ R. J. Dern, E. Beutler, A. S. Alving: The hemolytic effect of primaquine. II. The natural course of the hemolytic anemia and the mechanism of its self-limited character. In: J Lab Clin Med., 44(2), 1954, S. 171–176. PMID 13184224.
- ↑ E. Beutler, R. J. Dern, A. S. Alving: The hemolytic effect of primaquine. III. A study of primaquine-sensitive erythrocytes. In: J Lab Clin Med., 44(2), 1954, S. 177–184. PMID 13184225.
- ↑ E. L. Kimbro Jr., M. V. Sachs, J. V. Torbert: Mechanism of the hemolytic anemia induced by nitrofurantoin (furadantin); further observations on the incidence and significance of primaquine-sensitive red cells. In: Bull Johns Hopkins Hosp., 101(5), 1957, S. 245–257. PMID 13472250.
- ↑ Peter Karlson: Kurzes Lehrbuch der Biochemie für Mediziner und Naturwissenschaftler. ISBN 3-13-357814-6, S. 197.
- ↑ M. Kaplan, M. Herschel, C. Hammerman, J. D. Hoyer, D. K. Stevenson: Hyperbilirubinemia among African American, glucose-6-phosphate dehydrogenase-deficient neonates. In: Pediatrics, 114(2), 2004, S. e213–e219.
- ↑ G. Vaca, E. Arambula, A. Esparza: Molecular heterogeneity of glucose-6-phosphate dehydrogenase deficiency in Mexico: overall results of a 7-year project. In: Blood Cells Mol Dis., 28(3), 2002, S. 436–444.
- ↑ S. Castro, R. Weber, V. Dadalt, V. Tavares, R. Giugliani: Prevalence of G6PD deficiency in newborns in the south of Brazil. In: J Med Screen., 13(2), 2006, S. 85–86.
- ↑ Y. M. Abdulrazzaq, R. Micallef, M. Qureshi u. a.: Diversity in expression of glucose-6-phosphate dehydrogenase deficiency in females. In: Clin Genet., 55(1), 1999, S. 13–19. PMID 10066026
- ↑ A. S. Al: Campaign to control genetic blood diseases in Bahrain. In: Community Genet., 8(1), 2005, S. 52–55.
- ↑ K. Ohkura, T. Miyashita, H. Nakajima u. a.: Distribution of polymorphic traits in Mazandaranian and Guilanian in Iran. In: Hum Hered., 34(1), 1984, S. 27–39. PMID 6234219
- ↑ S. A. Mesbah-Namin, M. H. Sanati, A. Mowjoodi, P. J. Mason, T. J. Vulliamy, M. R. Noori-Daloii: Three major glucose-6-phosphate dehydrogenase-deficient polymorphic variants identified in Mazandaran state of Iran. In: Br J Haematol., 117(3), 2002, S. 763–764. PMID 12028056
- ↑ M. Kaplan, C. Hammerman, R. Kvit, B. Rudensky, A. Abramov: Neonatal screening for glucose-6-phosphate dehydrogenase deficiency: sex distribution. In: Arch Dis Child Fetal Neonatal Ed., 71(1), 1994, S. F59–F60.
- ↑ K. Talafih, A. A. Hunaiti, N. Gharaibeh, M. Gharaibeh, S. Jaradat: The prevalence of hemoglobin S and glucose-6-phosphate dehydrogenase deficiency in Jordanian newborn. In: J Obstet Gynaecol Res., 22(5), 1996, S. 417–420. PMID 8987321
- ↑ I. Khneisser, S. M. Adib, J. Loiselet, A. Megarbane: Prevalence of G6PD deficiency and knowledge of diagnosis in a sample of previously unscreened Lebanese males: clinical implications. In: J Med Screen., 13(1), 2006, S. 26–28.
- ↑ A. Drousiotou, E. H. Touma, N. Andreou u. a.: Molecular characterization of G6PD deficiency in Cyprus. In: Blood Cells Mol Dis., 33(1), 2004, S. 25–30.
- ↑ S. Missiou-Tsagaraki: Screening for glucose-6-phosphate dehydrogenase deficiency as a preventive measure: prevalence among 1,286,000 Greek newborn infants. In: J Pediatr., 119(2), 1991, S. 293–299.
- ↑ M. Zaffanello, S. Rugolotto, G. Zamboni, R. Gaudino, L. Tato: Neonatal screening for glucose-6-phosphate dehydrogenase deficiency fails to detect heterozygote females. In: Eur J Epidemiol., 19(3), 2004, S. 255–257.
- ↑ A. Tagarelli, L. Bastone, R. Cittadella, V. Calabro, M. Bria, C. Brancati: Glucose-6-phosphate dehydrogenase (G6PD) deficiency in southern Italy: a study on the population of the Cosenza province. In: Gene Geogr., 5(3), 1991, S. 141–150. PMID 1841600.
- ↑ M. C. Martins, G. Olim, J. Melo, H. A. Magalhaes, M. O. Rodrigues: Hereditary anaemias in Portugal: epidemiology, public health significance, and control. In: J Med Genet., 30(3), 1993, S. 235–239.
- ↑ M. M. Manu-Pereira, A. Maya, V. Cararach u. a.: [Neonatal screening of hemoglobinopathies and glucose-6-phosphate dehydrogenase in Catalonia. Pilot study in anonymous not related population]. In: Med Clin (Barc)., 126(8), 2006, S. 281–285.
- ↑ N. A. Mir, M. Fakhri, M. Abdelaziz u. a.: Erythrocyte glucose-6-phosphate dehydrogenase status of newborns and adults in eastern Libya. In: Ann Trop Paediatr., 5(4), 1985, S. 211–213. PMID 2418771
- ↑ R. Blibech, Y. Gharbi, A. Mrad u. a.: Incidence of glucose-6-phosphate dehydrogenase (G6PD) deficiency in Tunisian populations. In: Nouv Rev Fr Hematol., 31(3), 1989, S. 189–191. PMID 2616266
- ↑ M. J. Bouma, M. Goris, T. Akhtar, N. Khan, N. Khan, E. Kita: Prevalence and clinical presentation of glucose-6-phosphate dehydrogenase deficiency in Pakistani Pathan and Afghan refugee communities in Pakistan; implications for the use of primaquine in regional malaria control programmes. In: Trans R Soc Trop Med Hyg., 89(1), 1995, S. 62–64. PMID 7747310
- ↑ W. Jiang, G. Yu, P. Liu u. a.: Structure and function of glucose-6-phosphate dehydrogenase-deficient variants in Chinese population. In: Hum Genet., 119(5), 2006, S. 463–478.
- ↑ S. L. Choubisa, L. Choubisa, S. Pande, Y. K. Srivastava: Incidence of abnormal haemoglobins and G-6-PD deficiency in school children of Udaipur (Rajasthan), India. In: J Trop Med Hyg., 90(4), 1987, S. 215–216. PMID 2443725
- ↑ H. Matsuoka, A. Ishii, W. Panjaitan, R. Sudiranto: Malaria and glucose-6-phosphate dehydrogenase deficiency in North Sumatra, Indonesia. In: Southeast Asian J Trop Med Public Health., 17(4), 1986, S. 530–536. PMID 3576282
- ↑ T. Kageoka, C. Satoh, K. Goriki u. a.: Electrophoretic variants of blood proteins in Japanese. IV. Prevalence and enzymologic characteristics of glucose-6-phosphate dehydrogenase variants in Hiroshima and Nagasaki. In: Hum Genet., 70(2), 1985, S. 101–108. PMID 3977788
- ↑ A. T. Hon, S. Balakrishnan, Z. Ahmad: Hyperbilirubinaemia and erythrocytic glucose 6 phosphate dehydrogenase deficiency in Malaysian children. In: Med J Malaysia., 44(1), 1989, S. 30–34. PMID 2626111
- ↑ A. M. Than, T. Harano, K. Harano, A. A. Myint, T. Ogino, S. Okadaa: High incidence of 3-thalassemia, hemoglobin E, and glucose-6-phosphate dehydrogenase deficiency in populations of malaria-endemic southern Shan State, Myanmar. In: Int J Hematol., 82(2), 2005, S. 119–123.
- ↑ N. Ali, M. Anwar, M. Ayyub, F. A. Bhatti, M. Nadeem, A. Nadeem: Frequency of glucose-6-phosphate dehydrogenase deficiency in some ethnic groups of Pakistan. In: J Coll Physicians Surg Pak., 15(3), 2005, S. 137–141.
- ↑ R. Joseph, L. Y. Ho, J. M. Gomez, V. S. Rajdurai, S. Sivasankaran, Y. Y. Yip: Mass newborn screening for glucose-6-phosphate dehydrogenase deficiency in Singapore. In: Southeast Asian J Trop Med Public Health., 30 Suppl 2, 1999, S. 70–71. PMID 11400790
- ↑ C. E. Rebholz, A. J. Michel, D. A. Maselli, K. Saipphudin, K. Wyss: Frequency of malaria and glucose-6-phosphate dehydrogenase deficiency in Tajikistan. In: Malar J., 5, 2006, S. 51.
- ↑ V. S. Tanphaichitr: Glucose-6-phosphate dehydrogenase deficiency in Thailand; its significance in the newborn. In: Southeast Asian J Trop Med Public Health., 30 Suppl 2, 1999, S. 75–78.
- ↑ V. S. Tanphaichitr, P. Pung-Amritt, S. Yodthong, J. Soongswang, C. Mahasandana, V. Suvatte: Glucose-6-phosphate dehydrogenase deficiency in the newborn: its prevalence and relation to neonatal jaundice. In: Southeast Asian J Trop Med Public Health., 26 Suppl 1, 1995, S. 137–141.
- ↑ V. S. Tanphaichitr, C. Mahasandana, V. Suvatte, S. Yodthong, P. Pung-Amritt, J. Seeloem: Prevalence of hemoglobin E, alpha-thalassemia and glucose-6-phosphate dehydrogenase deficiency in 1,000 cord bloods studied in Bangkok. In: Southeast Asian J Trop Med Public Health., 26 Suppl 1, 1995, S. 271–274. PMID 8629122
- ↑ P. Verle, D. H. Nhan, T. T. Tinh u. a.: Glucose-6-phosphate dehydrogenase deficiency in northern Vietnam. In: Trop Med Int Health., 5(3), 2000, S. 203–206.
- ↑ A. M. Moormann, P. E. Embury, J. Opondo u. a.: Frequencies of sickle cell trait and glucose-6-phosphate dehydrogenase deficiency differ in highland and nearby lowland malaria-endemic areas of Kenya. In: Trans R Soc Trop Med Hyg., 97(5), 2003, S. 513–514.
- ↑ R. P. Bonafede, M. C. Botha, P. Beighton: Glucose-6-phosphate dehydrogenase deficiency in the Greek population of Cape Town. In: S Afr Med J., 65(14), 1984, S. 547–549. PMID 6710260
- ↑ F. Kaddari, M. Sawadogo, J. Sancho u. a.: [Neonatal screening of glucose-6-phosphate dehydrogenase deficiency in umbilical cord blood]. In: Ann Biol Clin (Paris)., 62(4), 2004, S. 446–450.
- ↑ B. H. Wolf, R. B. Schutgens, N. J. Nagelkerke, R. S. Weening: Glucose-6-phosphate dehydrogenase deficiency in ethnic minorities in The Netherlands. In: Trop Geogr Med., 40(4), 1988, S. 322–330. PMID 3227552
- ↑ Standardization of procedures for the study of glucose-6-phosphate dehydrogenase. In: WHO Tech. Rep. Ser., World Health Organization (WHO), 1967, S. 366.
- ↑ A. S. Alving, P. E. Carson, C. L. Flanagan, C. E. Ickes: Enzymatic deficiency in primaquine-sensitive erythrocytes. In: Science, 124(3220), 1956, S. 484–485. PMID 13360274
- ↑ M. G. Persico, D. Toniolo, C. Nobile, M. D’Urso, L. Luzzatto: cDNA sequences of human glucose 6-phosphate dehydrogenase cloned in pBR322. In: Nature, 294(5843), 1981, S. 778–780.
Auf dieser Seite verwendete Medien
Menschliches X-Chromosom in zytogenetischer Sicht (G-Bänderung). Fokus auf G6PD-Mangel (rot markiert).
Autor/Urheber: Sab3el3eish, Lizenz: CC BY 3.0
This is a 4-year old boy which presented to Al-Mafraq Hospital for Pediatrics and Gynecology at Al-Mafraq, Jordan on the 1st of March , 2010 complaining of Yellowish Discoloration in his sclera which later proved to be a manifestation of hemolytic anemia due to G6PD deficiency following Fava beans consumption.
Autor/Urheber: Christaras A (copier). Original Author is Jfdwolff, Lizenz: CC BY-SA 3.0
3-dimensionale Struktur des Proteins/Enzyms Glucose-6-Phosphat-Dehydrogenase (G6PD) hergestellt aus dem PDB-Datensatz 1qki.pdb